题目内容
5.将一定质量的Mg、Cu组成的混合物投入适量稀硝酸中,固体恰好完全溶解时收集到标准状况下0.896LNO气体,向反应后溶液中加入2mol/L NaOH溶液70mL时金属离子恰好沉淀完全.则整个过程消耗的硝酸的物质的量为( )| A. | 0.18mol | B. | 0.16mol | C. | 0.14mol | D. | 0.12mol |
分析 Mg、Cu混合物与硝酸反应生成Mg(NO3)2、Cu(NO3)2,部分硝酸被还原为NO气体,反应后的溶液加入NaOH溶液使金属恰好沉淀完全,沉淀为Cu(OH)2、Mg(OH)2,反应后的溶质为NaNO3,根据硝酸钠的物质的量可知没有被还原的硝酸的物质的量,再根据NO的量得出硝酸的总物质的量.
解答 解:标况下0.896LNO气体的物质的量为:$\frac{0.896L}{22.4L/mol}$=0.04mol,即:被还原的硝酸的物质的量为0.04mol,
金属离子恰好沉淀完全时,此时溶质为NaNO3,根据钠离子守恒可知没有被还原的硝酸的物质的量为:n(HNO3)=n(NaOH)=2mol/L×0.07L=0.14mol,
所以参加反应的硝酸的总物质的量为:0.14mol+0.04mol=0.18mol,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确金属离子恰好沉淀完全时时溶质为NaNO3为解答关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生的分析、理解能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列关于仪器使用的说法正确的是( )
| A. | 在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器 | |
| B. | 熔融纯碱、烧碱时,不能选用石英坩埚,应该选用铁坩埚 | |
| C. | 蒸发结晶实验中,蒸发皿应放在石棉网上加热 | |
| D. | 在测量或监测温度时,温度计水银球碰到容器内壁不影响测量结果 |
16.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是( )
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温才过滤 |
13.下列说法中错误的是( )
| A. | 所有的非金属元素都分布在P区 | |
| B. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| C. | 原子的核外电子层数等于该元素所在的周期数 | |
| D. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
20.在一定温度下,NH4NO3分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在此反应中被氧化和被还原的氮原子数之比是( )
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
10.100g物质的量浓度为18mol/L,密度为ρg/mL的浓硫酸中,加入一定量的水稀释为9mol/L的硫酸溶液,则加入水的体积是( )
| A. | 大于100mL | B. | 小于100mL | C. | 等于100mL | D. | 等于100/ρ mL |
17.经测定乙烯的乙醇溶液中,氧的质量分数为20%,则此溶液中氢的质量分数为( )
| A. | 75% | B. | 13.6% | C. | 20% | D. | 25% |
14.化合物M(fumimycin)是从微生物中分离得到的,它显示出广谱抗菌活性.下列关于化全物M的说法中错误的是( )
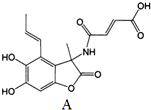

| A. | 化合物M的分子式为C16H15NO7 | |
| B. | 1 mol M在NaOH溶液中反应,最多消耗4 mol NaOH | |
| C. | 化合物M能发生加成反应,不能发生消去反应 | |
| D. | 化合物M能使酸性KMnO4溶液褪色 |
15.可用电解法将粗铜变为精铜,粗铜作阳极,精铜作阴极,足量硫酸铜溶液作电解液.粗铜在阳极的反应顺序是:Fe-2e-→Fe2+、Ni-2e-→Ni2+、Cu-2e-→Cu2+,杂质金和银不反应形成“阳极泥”.则以下叙述错误的是( )
| A. | 粗铜接电源的正极 | |
| B. | 电解一段时间后,溶液中Cu2+减小 | |
| C. | 若电路中通过1 mol电子,有0.5 mol铜被氧化 | |
| D. | 阴极反应只有Cu2++2e-→Cu |