题目内容
20.在一定温度下,NH4NO3分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在此反应中被氧化和被还原的氮原子数之比是( )| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
分析 在5NH4NO3═2HNO3+4N2↑+9H2O的反应中,氮元素由铵根中-3价升高为0价,被氧化;氮元素由硝酸根中+5价降低为0价,被还原,氮气既是还原产物也是氧化产物,根据电子转移守恒,判断被氧化的氮原子与被还原的氮原子数之比.
解答 解:在5NH4NO3═2HNO3+4N2↑+9H2O的反应中,氮元素由铵根中-3价升高为0价,被氧化,
氮元素由硝酸根中+5价降低为0价,被还原,氮气既是还原产物也是氧化产物,
根据电子转移守恒,可知被氧化的氮原子与被还原的氮原子物质的量之比为(5-0):[0-(-3)]=5:3,
即数目之比为5:3,
故选A.
点评 本题考查氧化还原反应基本概念与计算,侧重学生的分析、计算能力的考查,难度中等,关键根据化合价变化判断氧化剂与还原剂,再根据电子转移守恒判断被氧化的氮原子与被还原的氮原子物质的量之比.

练习册系列答案
相关题目
10.甲、乙是元素周期表中同一周期的两种元素,甲位于ⅡA族,其原子序数为x,乙位于ⅢA族,则乙的原子序数可能是( )
①x+1 ②x+11 ③x+25 ④x+26 ⑤x+10.
①x+1 ②x+11 ③x+25 ④x+26 ⑤x+10.
| A. | ① | B. | ②③ | C. | ①②③ | D. | 全部 |
11.下列说法中,正确的是( )
| A. | 氯乙烯、聚乙烯、苯乙炔都是不饱和烃 | |
| B. | 苯能与溴水在一定条件下发生取代反应 | |
| C. | 减少化石燃料使用,有利于降低空气中PM2.5(直径2.5μm以下细颗粒物)的含量 | |
| D. | 乙烯、苯、甲苯都能使高锰酸钾溶液褪色 |
8.下列物质中,能显示酸性,还能发生酯化反应和消去反应的是( )
| A. |  | B. | 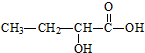 | C. |  | D. |  |
15.科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子的数目及核电荷的数目有关.氩原子与硫离子的核外电子排布相同,都是1s22s22p63s23p6下列说法正确的是( )
| A. | 两粒子的1s能级上电子的能量相同 | |
| B. | 两粒子的3p能级上的电子离核的距离相同 | |
| C. | 两粒子都达8电子稳定结构,化学性质相同 | |
| D. | 两粒子的电子发生跃迁时,产生的光谱不同 |
5.将一定质量的Mg、Cu组成的混合物投入适量稀硝酸中,固体恰好完全溶解时收集到标准状况下0.896LNO气体,向反应后溶液中加入2mol/L NaOH溶液70mL时金属离子恰好沉淀完全.则整个过程消耗的硝酸的物质的量为( )
| A. | 0.18mol | B. | 0.16mol | C. | 0.14mol | D. | 0.12mol |
10.最近医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖,则有关14C的不正确叙述是( )
| A. | 14C与12C60中碳原子化学性质相同 | B. | 14C与14N的质量数相同 | ||
| C. | 14C是12C60的同素异形体 | D. | 14C与12C、13C互为同位素 |
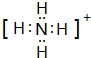 ,B-的化学式为OH-.
,B-的化学式为OH-.