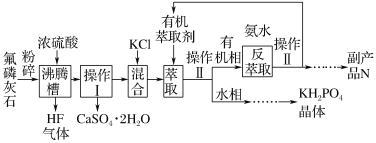
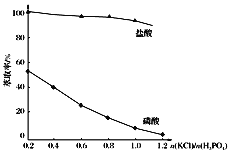
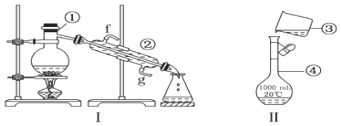
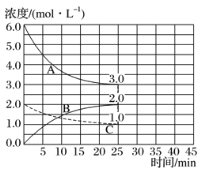
题目内容
【题目】X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)请写出元素Y的原子结构示意图_______________;其中元素W在周期表中的位置_______________________________。
(2)用电子式表示X在空气中生成的氧化物的形成过程:__________________________。
(3)X、Y、Z、W的原子半径由大到小的顺序为:_____________________________。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的离子方程式:_______________________________。
(5)写出Z与氢元素形成的10电子微粒化学式_____________________(任写两种)。
(6)元素X与元素Y相比,金属性较强的是_____(用元素符号表示),请举一例实验事实证明这一结论__________________________________________________________。
【答案】 第三周期第ⅦA族
第三周期第ⅦA族  Na>Al>Cl>N Cl2+ 2OH-= Cl-+ ClO-+H2O NH3、NH4+、NH2- Na Na与水反应要比Al剧烈(其它合理答案也可)
Na>Al>Cl>N Cl2+ 2OH-= Cl-+ ClO-+H2O NH3、NH4+、NH2- Na Na与水反应要比Al剧烈(其它合理答案也可)
【解析】
Z的原子次外层的电子数为2,最高价是+5价,所以Z是氮元素。核电荷数按照Z、X、Y、W的顺序增大,且W、X原子次外层电子数为8,所以根据其最高价可知,W是氯元素,X是Na,则Y是Al。据此分析解答。
(1)Al的原子序数是13,所以原子结构示意图为 。氯元素的原子序数是17,所以位于第三周期第ⅦA族。
。氯元素的原子序数是17,所以位于第三周期第ⅦA族。
(2)钠在空气中生成氧化钠,含有离子键的离子化合物,所以其形成过程是
 。
。
(3)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以X、Y、Z、W的原子半径由大到小的顺序为Na>Al>Cl>N。
(4)氯气和氢氧化钠溶液反应的离子方程式是Cl2+ 2OH-= Cl-+ ClO-+H2O。
(5)氮元素和氢元素形成的10电子微粒有NH3、NH4+、NH2-等。
(6)由于钠极易和水生成氢气和氢氧化钠,而A和水是不反应的,所以钠的金属性强于铝的金属性。