题目内容
8.实验室用100mL 1mol•L-1盐酸与锌粉反应制备氢气,下列措施能加快反应速率的是( )| A. | 改用300mL 1 mol•L-1盐酸 | B. | 降低温度 | ||
| C. | 用锌粒代替锌粉 | D. | 滴加少量CuCl2溶液 |
分析 增大盐酸与锌粒的反应速率,可通过外界条件对化学反应速率的影响来考虑,可增大浓度、升高温度,增大固体的表面积或形成原电池反应等因素来实现.
解答 解:A.盐酸浓度不变,反应速率不变,故A错误;
B.降低温度,活化分子百分数减小,反应速率减小,故B错误;
C.用等量锌粒代替锌粉,固体的表面积减小,反应速率减小,故C错误;
D.滴加少量CuCl2溶液,锌置换出铜,形成原电池反应,反应速率增大,故D正确.
故选D.
点评 本题考查化学反应速率的影响,侧重于基本理论知识的理解和运用的考查,为高频考点,难度不大,注意相关基础知识的积累.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
18.下列式子是某学生书写的C5H12的同分异构体的结构简式:①CH3CH2CH2CH2CH3 ②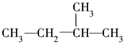 ③
③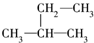 ④
④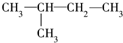 ⑤
⑤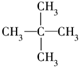
这些结构中出现重复的是( )
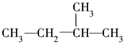 ③
③ ④
④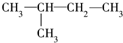 ⑤
⑤
这些结构中出现重复的是( )
| A. | ②和③ | B. | ④和⑤ | C. | ③和④ | D. | 均不重复 |
19.关于下面四个图说法正确的是( )


| A. | A图中正极是铁片 | |
| B. | B图中铜片上发生氧化反应 | |
| C. | C图中电子从通入O2一极沿导线流向通H2一极 | |
| D. | D图中负极反应式为Zn-2e-═Zn2+ |
16.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 6.0 g甲醛分子中共用电子对数目为0.4NA | |
| B. | 标准状况下,22.4 L辛烷完全燃烧生成CO2分子数为8NA | |
| C. | 14g乙烯和环丙烷组成的混合气体中,含有的氢原子数目为2NA | |
| D. | 电解精炼铜时,若阴极得到电子0.2NA个,则阳极质量一定减少6.4g |
3.下列叙述正确的是( )
| A. | 乙烯和苯都能使酸性高锰酸钾溶液褪色 | |
| B. | 工业上用电解氯化镁溶液的方法生产金属镁 | |
| C. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| D. | 淀粉和纤维素的分子式均为 (C6H10O5)n,它们互为同分异构体 |
13.下列有机物属于烃的是( )
| A. | C2H5OH | B. | CH2C12 | C. | C3H8 | D. | 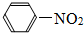 |
20.短周期元素W、X、Y、Z在周期表中的位置如图,其中Y所处的周期数与族序数相等.W最外层电子数是其内层电子数的3倍.下列说法不正确的是( )
| … | W | |||
| X | Y | … | Z |
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含有离子键 | |
| C. | 气态氢化物的稳定性:W>Z | |
| D. | W与Y形成的化合物可分别与NaOH溶液和盐酸反应 |
17.下列有关元素周期表的说法中正确的是( )
| A. | 有7个横行、7个纵行 | |
| B. | 铁元素属于主族元素 | |
| C. | 第1、2、3周期的元素属于短周期元素 | |
| D. | 0族元素原子的最外层上均有8个电子 |
18.下列实验操作中错误的是( )
| A. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| B. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 | |
| D. | 称量时,称量放在称量瓶中,置于托盘天平的左盘,砝码放在托盘的天平的右盘中 |