题目内容
19.关于下面四个图说法正确的是( )
| A. | A图中正极是铁片 | |
| B. | B图中铜片上发生氧化反应 | |
| C. | C图中电子从通入O2一极沿导线流向通H2一极 | |
| D. | D图中负极反应式为Zn-2e-═Zn2+ |
分析 A.铁应为负极;
B.锌比铜活泼,锌为负极;
C.通入氢气的一极为负极;
D.锌为负极,被氧化.
解答 解:A.该原电池中,铁为负极,碳为正极,正极析出氢气,负极生成亚铁离子,故A错误;
B.锌比铜活泼,锌为负极,负极发生氧化反应生成锌离子,故B错误;
C.氢气被氧化,通入氢气的一极为负极,故C错误;
D.锌为负极,电极方程式为Zn-2e-═Zn2+,故D正确.
故选D.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
9.下列除去杂质的方法中正确的是( )
①除去乙烷中少量的乙烯:通入适量H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
③除去硝基苯中少量的NO2:滴入适量的NaOH溶液后,过滤
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤除去蛋白质中少量离子:用半透膜,渗析.
①除去乙烷中少量的乙烯:通入适量H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
③除去硝基苯中少量的NO2:滴入适量的NaOH溶液后,过滤
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤除去蛋白质中少量离子:用半透膜,渗析.
| A. | ①②④ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
10.1mol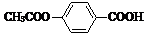 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )| A. | 2mol | B. | 3 mol | C. | 4 mol | D. | 5 mol |
7.下列说法正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子百分数,使有效碰撞次数增大 | |
| B. | 有气体参加的化学反应,若缩小反应容器的体积,可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了活化分子的百分数 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
14.下列根据事实所作出的结论正确的是( )
| 事实 | 结论 |
| A.甲乙两种物质,相对分子质量相同,结构不同 | 甲和乙一定是同分异构体 |
| B.灼烧棉织品、羊毛衫和涤纶衣物 | 有烧焦羽毛气味的是羊毛衫 |
| C.在淀粉溶液中加入市售的加碘食盐不出现蓝色 | 不能说明此盐不含碘元素 |
| D.完全燃烧产物是CO2和H2O的物质 | 一定只含C、H元素 |
| A. | A | B. | B | C. | C | D. | D |
4.人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”.以下有关主族元素原子的“未成对电子”的说法,错误的是( )
| A. | 核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” | |
| B. | 核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子” | |
| C. | 原子轨道中含有“未成对电子”的基态原子,其核外电子数可能为偶数 | |
| D. | 原子轨道中不含“未成对电子”的基态原子,其核外电子数一定为偶数 |
11.下列制备和收集气体的实验装置合理的是( )
| A. | 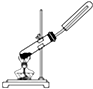 用氯化铵和氢氧化钠固体制NH3 | B. | 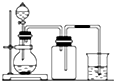 用铜片和稀硝酸制NO | ||
| C. | 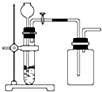 用锌粒和稀硫酸制H2 | D. | 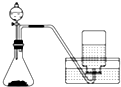 用H2O2和MnO2制O2 |
8.实验室用100mL 1mol•L-1盐酸与锌粉反应制备氢气,下列措施能加快反应速率的是( )
| A. | 改用300mL 1 mol•L-1盐酸 | B. | 降低温度 | ||
| C. | 用锌粒代替锌粉 | D. | 滴加少量CuCl2溶液 |
9.实验室用纯溴和苯在铁离子催化下反应制取溴苯,得到粗溴苯后,要用如下操作精制,正确的操作顺序是
①蒸馏 ②水洗分液 ③用干燥剂干燥 ④10%NaOH溶液洗分液( )
①蒸馏 ②水洗分液 ③用干燥剂干燥 ④10%NaOH溶液洗分液( )
| A. | ①②③④② | B. | ②④②③① | C. | ④②③①② | D. | ②④①②③ |