题目内容
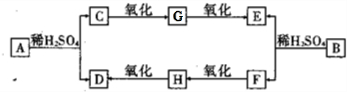
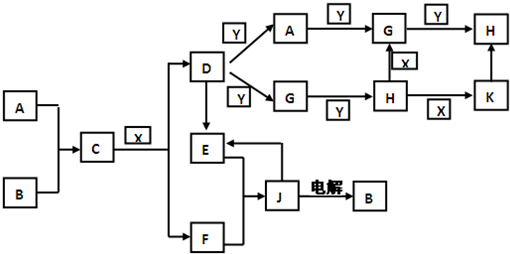
(12分)根据下图所示的关系填空,已知A为FeS2固体,C的焰色反应火焰呈黄色,其中①、③是硫酸工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体,F是红棕色固体。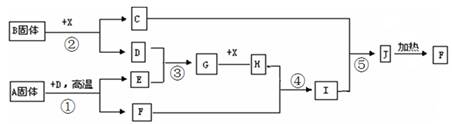
(1)物质X的化学式是 ____ 。
(2)化合物B中所包含的化学键有 和 __ 。
(3)反应④的离子方程式为 。
反应②的化学方程式为___ ___,其中还原剂是 。
(4)已知每生成16克E,放出106.5KJ的热量,则反应①的热化学反应方程式为 ___ 。(相对原子质量:Fe-56 S-32 O-16)
(1)H2O (2)非极性键、离子键
(3)Fe2O3+6H+ ==2Fe3++3H2O 2Na2O2+2H2O ="=" 4NaOH+O2↑ Na2O2
(4)4FeS2(s)+11O2(g)==2Fe2O3(s)+8SO2(g);ΔH =" -3408" kJ/mol
解析

 名校课堂系列答案
名校课堂系列答案有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
|
② |
|
|
|
|
|
|
⑦ |
⑧ |
②与⑧形成的液体化合物是常见的溶剂,则⑦元素在周期表中的位置是 ,②元素的氧化物的电子式是 ,②与⑧形成的化合物中存在的化学键是 ,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由弱到强的顺序是 (用化学式表示)。⑦、⑧两种元素形成的阴离子半径大小顺序是 (用离子符号填)。
(2)若甲、己、丙、丁、戊均为上述短周期元素中组成的单质或化合物,且甲、乙、丙为无色气体,戊为红棕色气体。根据下图所示转化关系推测:

①写出反应a的化学方程式: 。
②写出戊与丁反应的化学方程式: 。
(3)若下图中A、B、C、D、E分别是上述10种元素组成的单质或化合物。
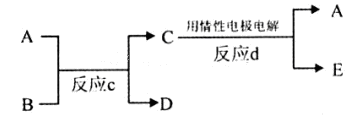
①若反应c是用A作电解池的阳极,电解B的水溶液,其中A是红色金属单质,E是具有黄绿色的气体。则反应d中阴极的电极反应式为: 。
②若反应c是在高温下进行的。其中B是暗红色固体,当物质C是一种两性化合物,则反应c的化学方程式为 。





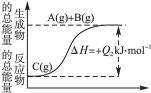
 N2+3H2
N2+3H2 N2O4
N2O4