题目内容
已知:X是一种常见无色液体,A和Y是生活中经常遇到的无色气体,B为短周期金属单质且在空气中点燃能发出耀眼白光.请根据下图所示各物质转化关系回答下列问题.(部分反应物、生成物可能没有标出)
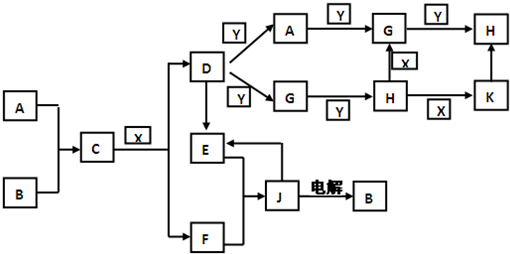
(1)请写出C的电子式:
 ;请写出C与稀盐酸反应的化学方程式:
;请写出C与稀盐酸反应的化学方程式:
(2)已知D和氯化氢反应可以生成E,请写出E和F在水溶液中反应生成J的化学方程式
(3)在一内置有铁网的密闭硬质玻璃管中充入2mol D,加强热,请写出发生反应的化学方程式
(4)已知常温下,H可以与L相互转化,请写出该反应的化学方程式
在一密闭针筒中充入一定量H和L的混合气体,建立平衡后迅速推针筒至针筒内原气体体积的1/2,请描述针筒内气体颜色的变化
(5)一定温度下,在一恒定体积的密闭容器中充入一定量H建立平衡,某时刻再向容器中充入一定量H,则H的体积分数

(1)请写出C的电子式:


Mg3N2+6HCl=3MgCl2+2NH4Cl
Mg3N2+6HCl=3MgCl2+2NH4Cl
.(2)已知D和氯化氢反应可以生成E,请写出E和F在水溶液中反应生成J的化学方程式
Mg(OH)2+2NH4Cl=MgCl2+2NH3?H2O
Mg(OH)2+2NH4Cl=MgCl2+2NH3?H2O
.(3)在一内置有铁网的密闭硬质玻璃管中充入2mol D,加强热,请写出发生反应的化学方程式
2NH3 N2+3H2
N2+3H2
 N2+3H2
N2+3H22NH3 N2+3H2
N2+3H2
.保持温度恒定,如经过一段时间玻璃管内压强是初始压强的1.5倍,则D物质的转化率为 N2+3H2
N2+3H250%
50%
,D物质的体积分数为33.3%
33.3%
.(4)已知常温下,H可以与L相互转化,请写出该反应的化学方程式
2NO2  N2O4
N2O4
 N2O4
N2O42NO2  N2O4
N2O4
 N2O4
N2O4在一密闭针筒中充入一定量H和L的混合气体,建立平衡后迅速推针筒至针筒内原气体体积的1/2,请描述针筒内气体颜色的变化
先变深后变浅,但比最开始的颜色要深
先变深后变浅,但比最开始的颜色要深
.(5)一定温度下,在一恒定体积的密闭容器中充入一定量H建立平衡,某时刻再向容器中充入一定量H,则H的体积分数
减小
减小
(填“增大”、“减小”、“不变”、“无法确定”).分析:X是一种常见无色液体为H2O,A和Y是生活中经常遇到的无色气体为O2、N2,B为短周期金属单质且在空气中点燃能发出耀眼白光说明为Mg,AB反应生成的C能与X反应,说明A为N2;C为Mg3N2;Mg3N2和水反应生成氨气和氢氧化镁;D和氯化氢反应可以生成E,说明D为NH3,F为Mg(OH)2,E为NH4Cl,J为MgCl2,D(NH3)和Y反应生成A(N2)或G,A(N2)和氧气反应生成G(NO),和氧气反应生成H(NO2),所以依据转化关系判断K为HNO3;依据判断出的物质分析判断回答问题;
解答:解:(1)推断出的C为氮化镁Mg3N2,电子式为: ;与稀盐酸反应的化学方程式:Mg3N2+6HCl=3MgCl2+2NH4Cl
;与稀盐酸反应的化学方程式:Mg3N2+6HCl=3MgCl2+2NH4Cl
故答案为: ;Mg3N2+6HCl=3MgCl2+2NH4Cl;
;Mg3N2+6HCl=3MgCl2+2NH4Cl;
(2)E(NH4Cl)和F(Mg(OH)2)在水溶液中反应生成J(MgCl2)的化学方程式:Mg(OH)2+2NH4Cl=MgCl2+2NH3?H2O,故答案为:Mg(OH)2+2NH4Cl=MgCl2+2NH3?H2O;
(3)铁网的密闭硬质玻璃管中充入2mol D(NH3),加强热可以反应最后达到平衡:2NH3 N2+3H2;经过一段时间玻璃管内压强是初始压强的1.5倍;根据平衡计算氨气的转化率:2NH3
N2+3H2;经过一段时间玻璃管内压强是初始压强的1.5倍;根据平衡计算氨气的转化率:2NH3 N2+3H2,假设氨气消耗量为x
N2+3H2,假设氨气消耗量为x
2NH3 N2+3H2
N2+3H2
起始量 2mol 0 0
变化量 x 0.5mol 1.5mol
平衡量 2-x 0.5mol 1.5mol
压强是初始压强的1.5倍,即物质的量是初始压强的1.5倍:2-x+0.5mol+1.5mol=2mol×1.5,x=1,所以氨气转化率为50%;氨气的体积分数=
×100%=33.3%
故答案为:50%; 33.3%
(4)H(NO2)可以与L相互转化二氧化氮聚合为四氧化二氮,反应的化学方程式为:2NO2 N2O4; 立平衡后迅速推针筒至针筒内原气体体积的1/2,体积缩小浓度增大,颜色变深,但压强增大平衡正向进行,现象为:先变深后变浅,但比最开始的颜色要深;
N2O4; 立平衡后迅速推针筒至针筒内原气体体积的1/2,体积缩小浓度增大,颜色变深,但压强增大平衡正向进行,现象为:先变深后变浅,但比最开始的颜色要深;
故答案为:2NO2 N2O4; 先变深后变浅,但比最开始的颜色要深;
N2O4; 先变深后变浅,但比最开始的颜色要深;
(5)一定温度下,在一恒定体积的密闭容器中充入一定量H(NO2)建立平衡,某时刻再向容器中充入一定量H(NO2),相当于增大压强,平衡正向进行,NO2的体积减小,故答案为:减小
 ;与稀盐酸反应的化学方程式:Mg3N2+6HCl=3MgCl2+2NH4Cl
;与稀盐酸反应的化学方程式:Mg3N2+6HCl=3MgCl2+2NH4Cl故答案为:
 ;Mg3N2+6HCl=3MgCl2+2NH4Cl;
;Mg3N2+6HCl=3MgCl2+2NH4Cl;(2)E(NH4Cl)和F(Mg(OH)2)在水溶液中反应生成J(MgCl2)的化学方程式:Mg(OH)2+2NH4Cl=MgCl2+2NH3?H2O,故答案为:Mg(OH)2+2NH4Cl=MgCl2+2NH3?H2O;
(3)铁网的密闭硬质玻璃管中充入2mol D(NH3),加强热可以反应最后达到平衡:2NH3
 N2+3H2;经过一段时间玻璃管内压强是初始压强的1.5倍;根据平衡计算氨气的转化率:2NH3
N2+3H2;经过一段时间玻璃管内压强是初始压强的1.5倍;根据平衡计算氨气的转化率:2NH3 N2+3H2,假设氨气消耗量为x
N2+3H2,假设氨气消耗量为x2NH3
 N2+3H2
N2+3H2起始量 2mol 0 0
变化量 x 0.5mol 1.5mol
平衡量 2-x 0.5mol 1.5mol
压强是初始压强的1.5倍,即物质的量是初始压强的1.5倍:2-x+0.5mol+1.5mol=2mol×1.5,x=1,所以氨气转化率为50%;氨气的体积分数=
| 2-1 |
| 2-1+0.5+1.5 |
故答案为:50%; 33.3%
(4)H(NO2)可以与L相互转化二氧化氮聚合为四氧化二氮,反应的化学方程式为:2NO2
 N2O4; 立平衡后迅速推针筒至针筒内原气体体积的1/2,体积缩小浓度增大,颜色变深,但压强增大平衡正向进行,现象为:先变深后变浅,但比最开始的颜色要深;
N2O4; 立平衡后迅速推针筒至针筒内原气体体积的1/2,体积缩小浓度增大,颜色变深,但压强增大平衡正向进行,现象为:先变深后变浅,但比最开始的颜色要深;故答案为:2NO2
 N2O4; 先变深后变浅,但比最开始的颜色要深;
N2O4; 先变深后变浅,但比最开始的颜色要深;(5)一定温度下,在一恒定体积的密闭容器中充入一定量H(NO2)建立平衡,某时刻再向容器中充入一定量H(NO2),相当于增大压强,平衡正向进行,NO2的体积减小,故答案为:减小
点评:本题考查了物质转化关系的判断,物质性质的综合应用,主要考查物质性质特征的运用,电子式的书写,化学方程式的书写原则,化学平衡的计算判断,影响化学平衡的因素分析,题目综合性强,需要知识的熟练掌握.

练习册系列答案
相关题目





 ①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
 X的化学反应类型是 反应。
X的化学反应类型是 反应。