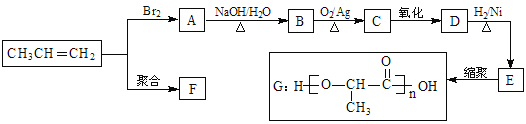
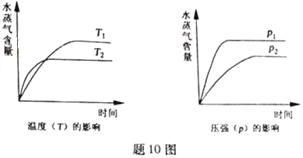
题目内容
【题目】①盐酸、②铁、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是______ (填序号,下同);水溶液能使紫色石蕊溶液变红的是______ 。
(2)写出盐酸的电离方程式___________。
(3)写出二氧化硅与氢氧化钠溶液反应的化学方程式_____________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_______。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者_______后者(填“>”、“<”或“=”)。
(5)氯碱工业是以电解饱和食盐水为基础的基本化学工业。电解饱和食盐水的产物中一种是所有气体中密度最小的气体、一种是黄绿色气体和一种易溶、易电离的碱,则电解食盐水的化学方程式:___________。
【答案】③ ① HCl=H++Cl- SiO2+2NaOH=Na2SiO3+H2O HCO3-+H+=H2O+CO2↑ = 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
【解析】
(1)由金属阳离子(或铵根离子)和酸根离子组成的化合物属于盐;酸使紫色石蕊溶液变红;
(2)盐酸是强酸,完全电离产生氢离子和氯离子;
(3)二氧化硅与氢氧化钠反应生成硅酸钠和水,据此写出反应的方程式;
(4)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,根据离子方程式的书写方法书写;二者都可与盐酸反应生成二氧化碳气体,结合方程式判断;
(5)根据电解饱和食盐水的电解原理,阴极产生氢气和氢氧化钠,阳极产生氯气,写出电解饱和食盐水的电解方程式。
(1)①盐酸属于酸、能使紫色石蕊溶液变红②铁是单质③碳酸氢钠是盐④二氧化硅是氧化物;故答案为:③;①;
(2)盐酸是强酸,完全电离产生氢离子和氯离子,方程式为:HCl=H++Cl-,故答案为:HCl=H++Cl-;
(3)二氧化硅与氢氧化钠溶液反应生成了硅酸钠和水,反应的离子方程式为:SiO2+2NaOH=Na2SiO3+H2O,故答案为:SiO2+2NaOH=Na2SiO3+H2O;
(4)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,反应的离子方程式为:HCO3-+H+=H2O+CO2↑;碳酸氢钠与足量盐酸反应的化学方程式为:NaHCO3+ HCl= NaCl+ H2O+CO2↑,碳酸钠与足量盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,由以上两个化学方程式可以看出,等物质的量的Na2CO3和NaHCO3分别与HCl反应,产生CO2的物质的量之比为:1: 1;故答案为:HCO3-+H+=H2O+CO2↑;=;
(5)通电后阴极氢离子放电,阴极产生氢气和氢氧化钠,阳极上氯离子放电产生氯气,电解反应方程式: 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;故答案为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。