题目内容
【题目】按要求填空:
(1)在室温下,等体积、等浓度的氢氧化钠与醋酸混合后溶液呈__性,溶液中c(Na+)__c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈__性,溶液中c(Na+)___c(CH3COO-)(填“>”“=”或“<”);
(2)下列溶液,①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液,按pH由小到大顺序为___。
(3)CuSO4的水溶液呈酸性的原因是(用离子方程式表示):____;实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于较浓的硫酸中,然后再用蒸馏水稀释到所需的浓度,以___(填“促进”、“抑制”)其水解。
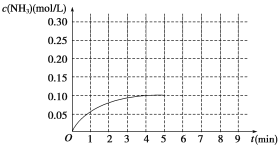
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有____,其浓度由大到小的顺序为_____,氨水的浓度a__0.01 mol·L-1(填“>”、“ <”或“=”)。
(5)已知:难溶电解质Cu(OH)2在常温下的KSP=2×10-20,则常温下:某CuSO4溶液中c(Cu2+)=0.02molL-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为____。
(6)某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:


①酸浸后加入H2O2的目的是_____________,调pH的最适宜范围为_______。
②调pH过程中加入的试剂最好是_________。
A.NaOH B.CuO C.NH3·H2O D.Cu2(OH)2CO3
③煮沸CuSO4溶液的原因是_____;向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,反应的化学方程式________。
【答案】碱 > 酸 < ②①④③ Cu2++2H2O![]() Cu(OH)2+2H+ 抑制 H-、H+、NH4+、Cl- c(Cl-)=c(NH4+)>c(H+)=c(OH-) > 5 将Fe2+氧化为Fe3+,便于调整pH使其与Cu2+分离 3.2~4.4 BD 除净溶液中的H2O2,避免影响下一步CuCl的生成 2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+Na2SO4+H2SO4
Cu(OH)2+2H+ 抑制 H-、H+、NH4+、Cl- c(Cl-)=c(NH4+)>c(H+)=c(OH-) > 5 将Fe2+氧化为Fe3+,便于调整pH使其与Cu2+分离 3.2~4.4 BD 除净溶液中的H2O2,避免影响下一步CuCl的生成 2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+Na2SO4+H2SO4
【解析】
(1)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,恰好生成醋酸钠,由化学式可知,阴阳离子之比为1:1,醋酸根离子水解显碱性,则c(Na+)>c(CH3COO),pH=13的氢氧化钠,其浓度为0.1mol/L,pH=1的醋酸,其浓度大于0.1mol/L,等体积混合后,醋酸过量;根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),醋酸过量,溶液呈酸性,所以c(H+)>c(OH-),则c(Na+)<c(CH3COO);
(2)①HCl是强电解质,所以0.1mol/L HCl溶液中氢离子浓度为0.1mol/L;②硫酸是二元强酸,所以0.1mol/L H2SO4溶液中氢离子浓度为0.2mol/L;③NaOH是一元强碱,氢离子浓度最小,0.1mol/L NaOH溶液中氢离子浓度为1013mol/L;④醋酸是一元弱酸,部分电离,所以0.1mol/L CH3COOH溶液中氢离子浓度小于0.1mol/L,则这四种溶液中氢离子浓度大小顺序是③④①②,氢离子浓度越小,pH越大,则pH由小到大顺序为②①④③;
(3)CuSO4是强酸弱碱盐,铜离子水解方程式为Cu2++2H2O![]() Cu(OH)2+2H+,水解后溶液中c(H+)>c(OH),所以溶液呈酸性,即常温下pH<7;为防止CuSO4水解,所以配制CuSO4溶液时将CuSO4先溶于较浓的硫酸中,抑制其水解,然后稀释。
Cu(OH)2+2H+,水解后溶液中c(H+)>c(OH),所以溶液呈酸性,即常温下pH<7;为防止CuSO4水解,所以配制CuSO4溶液时将CuSO4先溶于较浓的硫酸中,抑制其水解,然后稀释。
(4)在一水合氨与氯化氢恰好反应生成氯化铵溶液时,铵根离子在溶液中部分水解,促进了水的电离,水的电离程度增大,溶液显酸性,当溶液显中性时,氨水稍稍过量,溶液中溶质为氯化铵和一水合氨,溶液中存在的离子为:OH、H+、NH4+、Cl;反应后的溶液显中性,则一定满足c(H+)=c(OH),根据电荷守恒c(NH4+)+c(H+)=c(Cl)+c(OH)可知:c(NH4+)=c(Cl),离子浓度大小为:c(Cl)=c(NH4+)>c(H+)=c(OH);当a=0.01时,氨水与盐酸等体积等浓度混合,两溶液恰好反应生成氯化铵溶液,铵根离子水解导致溶液显示酸性,如溶液显示中性,则氨水稍稍过量,即a>0.01,
(5)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH)![]() =
=![]() mol/L=109mol/L,则c(H+)
mol/L=109mol/L,则c(H+)![]() mol/L=105mol/L,所以pHlg(105)=5;
mol/L=105mol/L,所以pHlg(105)=5;
(6)由流程可知,加硫酸溶解后,加入过氧化氢发生2Fe2++H2O2+2H+=2Fe3++2H2O,调节pH为3.2~4.4,使铁离子转化为沉淀,过滤分离出Fe(OH)3,Fe(OH)3加热生成铁红,煮沸硫酸铜溶液,除去溶液中的过氧化氢,向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,发生2Cl-+2Cu2++SO32-=2CuCl↓+SO42-+2H+;
①根据分析,酸浸后加入H2O2的目的是将亚铁离子氧化为铁离子,便于调整pH使其与Cu2+分离;根据表格数据,调pH的最适宜范围为3.2~4.4,使铁离子转化为沉淀,过滤分离出Fe(OH)3;
②调pH过程中加入的试剂最好是CuO或Cu2(OH)2CO3,促进铁离子水解,且不引入新杂质,
答案选BD。
③煮沸CuSO4溶液的目的是除净溶液中的H2O2,避免影响下一步生成CuCl;向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,该反应的化学方程式为2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+Na2SO4+H2SO4。