题目内容
4.根据同周期元素性质的递变规律填写下列空白.(同周期元素,从左到右)元素的金属性逐渐减弱,非金属性逐渐增强.(填“金属”或“非金属”)
元素原子的得电子能力逐渐增强,失电子能力逐渐减弱.
元素的最高正价由+1价递增到+7价,而最低负价由-4价递增到-1价(O、F除外).
分析 同周期自左而右,核电荷数增大,原子半径减小,原子核对电子吸引增强,失去电子能力减弱,获得电子的能力增强.
解答 解:同周期自左而右,核电荷数增大,原子半径减小,原子核对电子吸引增强,失去电子能力减弱,获得电子的能力增强,故同周期从左到右,金属性逐渐减弱,非金属性逐渐增强,元素的最高正价由+1价升高到+7价,最低价由-4价升高到-1价,故答案为:金属;非金属;得;失;+1;+7;-4;-1.
点评 本题主要考查同周期元素性质递变规律,比较基础,注意从原子结构理解金属性、非金属性递变规律.

练习册系列答案
相关题目
15.下列说法正确的是( )
①新制氯水的氧化性强于久置氯水;
②氯气的性质活泼,它与氢气混合后立即发生爆炸;
③实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收
④检验Cl2中是否混有HCl气体,方法是将气体通入硝酸银溶液中
⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水
⑥干燥的Cl2能使湿润的有色布条褪色,说明干燥的Cl2有漂白性.
①新制氯水的氧化性强于久置氯水;
②氯气的性质活泼,它与氢气混合后立即发生爆炸;
③实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收
④检验Cl2中是否混有HCl气体,方法是将气体通入硝酸银溶液中
⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水
⑥干燥的Cl2能使湿润的有色布条褪色,说明干燥的Cl2有漂白性.
| A. | ①②③④⑤⑥ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①③⑤ |
12.下列有机物同分异构体数目判断错误的是( )
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C5H12 | 3 |
| B | 分子式为C5H10,能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,能与Na反应生成氢气 | 4 |
| D | 分子式为C4H8O2,能与NaHCO3反应 | 3 |
| A. | A | B. | B | C. | C | D. | D |
13.短周期金属元素A~E在元素周期表中的相对位置如表所示,下面判断正确的是( )
| A | B | |
| C | D | E |
| A. | 原子半径:C<D<E | |
| B. | 金属性:A>C | |
| C. | 氢氧化物的化学式及其碱性:COH>D(OH)2>E(OH)3 | |
| D. | 最外层电子数:A>B |
14.化学方程式a C2H2+b O2点燃_c H2O+d CO2配平后a、b、c、d之和为( )
| A. | 15 | B. | 14 | C. | 13 | D. | 10 |
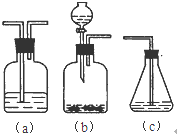
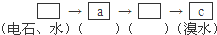 (填字母符号)
(填字母符号)