题目内容
7.F、Cl和Br都是 VIIA族元素,关于这三种元素原子的说法正确的是( )| A. | 原子半径:F>Cl>Br | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数都相同 | D. | 最外层电子数依次增多 |
分析 F、Cl和Br都是VIIA族元素,最外层电子数都为7,原子核电子层分别为2、3、4,同主族元素从上到下原子半径逐渐增大,以此解答该题.
解答 解:A.同主族元素从上到下原子半径逐渐增大,原子半径Br>Cl>F,故A错误;
B.F、Cl和Br都是VIIA族元素,最外层电子数都为7,最外层电子数都相同,故B正确;
C.F、Cl和Br原子核电子层分别为2、3、4,核外电子层数不相同,故C错误;
D.最外层电子数都为7,故D错误.
故选B.
点评 本题考查同主族元素的结构和性质比较,题目难度不大,本题注意同主族元素的结构特点和性质的递变规律,学习中注重相关基础知识的积累.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
17.下列各组物质中,前者为附着在容器内壁的污物,后者能除去前者的药品是( )
①银镜-硝酸
②油脂-热Na2CO3溶液
③水垢-醋酸
④硫黄-CS2
⑤苯酚-酒精.
①银镜-硝酸
②油脂-热Na2CO3溶液
③水垢-醋酸
④硫黄-CS2
⑤苯酚-酒精.
| A. | 只有①③⑤ | B. | 只有①④⑤ | C. | 只有②③⑤ | D. | 全部 |
18.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.
下表列出了①~⑩十种元素在周期表中的位置:
请回答下列问题:
(1)十种元素中化学性质最不活泼的是He(填元素符号 ).
(2)在②、③、④三种元素的氧化物对应的水化物中,碱性最强 的是NaOH(填化学式 ),其中含有化学键的类型有离子键、共价键.
(3)元素①、②、⑤原子半径由大到小的顺序为K>Na>H(填元素符号 ).
(4)元素⑦、⑧、⑨氢化物的稳定性由强到弱的顺序为HF>HCl>HBr(填化学式 ).
(5)十种元素中有一种元素的氢化物水溶液呈碱性,该氢化物的电子式为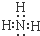 .
.
(6)十种元素中Al(填元素符号 )的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
(1)十种元素中化学性质最不活泼的是He(填元素符号 ).
(2)在②、③、④三种元素的氧化物对应的水化物中,碱性最强 的是NaOH(填化学式 ),其中含有化学键的类型有离子键、共价键.
(3)元素①、②、⑤原子半径由大到小的顺序为K>Na>H(填元素符号 ).
(4)元素⑦、⑧、⑨氢化物的稳定性由强到弱的顺序为HF>HCl>HBr(填化学式 ).
(5)十种元素中有一种元素的氢化物水溶液呈碱性,该氢化物的电子式为
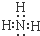 .
.(6)十种元素中Al(填元素符号 )的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
15.有些商贩为了使银耳增白,就用硫磺(燃烧硫磺)对银耳进行熏制,用这种方法制取的洁白的银耳对人体是有害的.这些不法商贩制取银耳利用的是( )
| A. | S的漂白性 | B. | S的氧化性 | C. | SO2的漂白性 | D. | SO2的还原性 |
2.在下列反应中,硫元素表现出氧化性的是( )
| A. | 稀硫酸与锌反应 | B. | 二氧化硫与氧气反应 | ||
| C. | 浓硫酸与铜反应 | D. | 三氧化硫与水反应 |
12.化学与生活密切相关,下列说法正确的是( )
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| D. | 乙烯和苯都能使溴水褪色,褪色的原因不同 |
12.下列有机物同分异构体数目判断错误的是( )
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C5H12 | 3 |
| B | 分子式为C5H10,能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,能与Na反应生成氢气 | 4 |
| D | 分子式为C4H8O2,能与NaHCO3反应 | 3 |
| A. | A | B. | B | C. | C | D. | D |
