题目内容
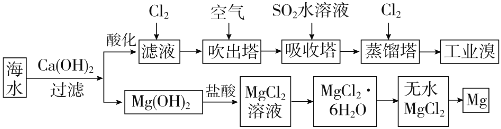
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以![]() 形式存在。化学课外小组将海带灼烧成灰,用水浸泡一段时间,得到海带灰悬浊液,然后按以下实验流程提取
形式存在。化学课外小组将海带灼烧成灰,用水浸泡一段时间,得到海带灰悬浊液,然后按以下实验流程提取![]() 单质(已知
单质(已知![]() 可以氧化
可以氧化![]() ):
):
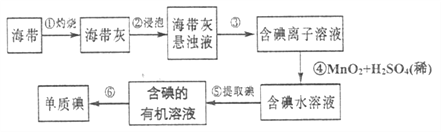
(1)指出制取碘的过程中有关的实验操作名称:③_________⑤__________。
(2)提取碘的过程中,可供选择的有机溶剂是__________(填字母代号)。
A. 酒精 B. ![]() C. 醋酸
C. 醋酸
(3)步骤④中每消耗![]() 转移
转移![]() 电子,生成
电子,生成![]() ,则发生反应的离子方程式为___________。
,则发生反应的离子方程式为___________。
(4)为实现步骤⑤的转化,实验室里有烧杯、玻璃棒、量简以及必要的夹持仪器、物品。尚缺少的玻璃仪器是___________。
(5)多次通过步骤⑤操作,可获取较高浓度的含碘有机溶液。若从中再提取![]() ,可以加入
,可以加入![]() 的
的![]() 溶液,将
溶液,将![]() 转化成可溶于水的含碘化合物:
转化成可溶于水的含碘化合物: ![]() 。经操作I分离得到含碘化合物的水溶液,再向其中加入过量的45%的硫酸溶液,生成
。经操作I分离得到含碘化合物的水溶液,再向其中加入过量的45%的硫酸溶液,生成![]() 沉淀,经操作II获得碘单质。则操作I的名称是_________,操作II的名称是________(填字母)。
沉淀,经操作II获得碘单质。则操作I的名称是_________,操作II的名称是________(填字母)。
A. 过滤 B. 蒸发 C. 蒸馏 D. 分液
【答案】 ③过滤 ⑤萃取分液 B ![]() 分液漏斗 D A
分液漏斗 D A
【解析】(1)海带灰的悬浊液需要过滤得到含碘离子溶液;碘易溶在有机溶剂中,所以操作⑤是萃取分液。(2)A. 酒精与水互溶,不能萃取碘水中的碘,A错误;B.碘易溶在四氯化碳中,且四氯化碳不溶于水,所以可以作萃取剂,B正确;C. 醋酸与水互溶,不能萃取碘水中的碘,C错误,答案选B;(3)二氧化锰氧化碘离子生成单质碘的离子方程式为MnO2+2I-+4H+=Mn2++I2+2H2O;(4)由于是萃取分液,所以尚缺少的玻璃仪器是分液漏斗。(5)有机溶剂不溶于水,经操作I分离得到含碘化合物的水溶液,因此是分液,答案选D。单质碘在水中的溶解度很小,经操作II获得碘单质,因此操作II的名称是过滤,答案选A。

【题目】某化学实验兴趣小组在“探究氯水与溴化亚铁溶液反应”的实验中发现:“在足量的溴化亚铁溶液中,加入1-2滴氯水,振荡后溶液呈黄色。”
【资料】 | 溴水是溴单质的水溶液,因溶有溴单质而呈黄色; 溶有溴的 |
根据已有化学知识及资料,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
猜想①:溶液呈黄色是因为![]() 被氧化成
被氧化成![]() 所致:
所致:
猜想②:溶液呈黄色是因为![]() 被氧化成
被氧化成![]() 所致。
所致。
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验。请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
试剂 | 酚酞试液、 | ||
方案 | 操作步骤 | 实验现象 | 结论 |
1 | 取所述黄色溶液于试管中,滴加________并振荡 | 溶液变红色 | 猜想①正确 |
2 | 取所述黄色溶液于试管中,滴加_______并振荡 | ____________ | |
(3)实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了![]() 的还原性比
的还原性比![]() _________(填“强”或“弱”)。
_________(填“强”或“弱”)。
(4)实验反思
根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入![]() 并充分振荡后静置,观察到的现象是___________。
并充分振荡后静置,观察到的现象是___________。