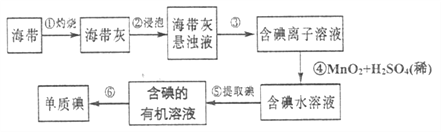
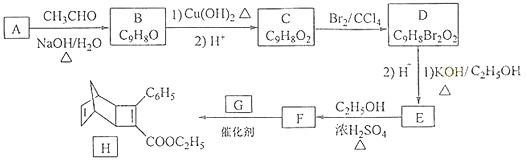
题目内容
【题目】下列有关晶体的叙述中,不正确的是( )
A.金刚石的网状结构中,由共价键形成的碳原子环,其中最小的环上有6个碳原子
B.在氯化钠晶体中,每个Na+或Cl﹣的周围紧邻6个Cl﹣或6个Na+
C.干冰晶体熔化时,1mol干冰要断裂2mol碳氧双键
D.在氯化铯晶体中,每个Cs+周围紧邻8个Cl﹣ , 每个Cl﹣周围也紧邻8个Cs+
【答案】C
【解析】解:A.金刚石结构中,每个碳原子能形成4个共价键,由共价键形成的最小碳环上有6个碳原子,故A正确;
B、氯化钠的晶胞图为  ,则氯化钠晶胞中,钠离子的配位数为6,即每个Na+或Cl﹣的周围都紧邻6个Cl﹣或Na+ , 故B正确;
,则氯化钠晶胞中,钠离子的配位数为6,即每个Na+或Cl﹣的周围都紧邻6个Cl﹣或Na+ , 故B正确;
C.干冰晶体熔化时,碳氧双键不发生断裂,故C错误;
D.氯化铯的晶胞图为  ,在CsCl晶体中每个Cs+周围都紧邻8个Cl﹣ , 每个Cl﹣周围也紧邻8个Cs+ , 故D正确;
,在CsCl晶体中每个Cs+周围都紧邻8个Cl﹣ , 每个Cl﹣周围也紧邻8个Cs+ , 故D正确;
故选C.
【考点精析】本题主要考查了离子晶体和原子晶体的相关知识点,需要掌握离子间通过离子键结合而成的晶体叫作离子晶体;相邻原子间以共价键相结合而形成空间网状结构的晶体叫原子晶体才能正确解答此题.

练习册系列答案
相关题目