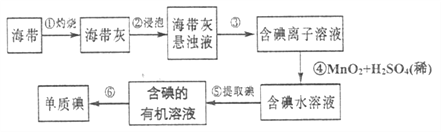
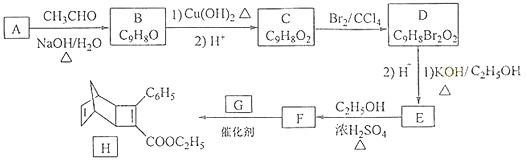
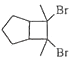
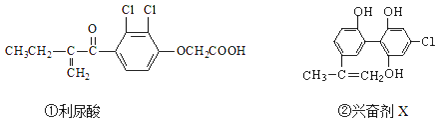��Ŀ����
����Ŀ����֪A�������������������Ľ�����BΪ����ɫ��ĩ���ڳ�����CΪ��ɫҺ�壬E��G��H��I��JΪ���壬����HΪ����ɫ������Ϊ��ɫ��J��ʹʪ��ĺ�ɫʯ����ֽ������ͼ�в��ֲ�������ȥ����
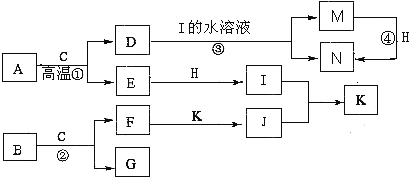
����д���пհ�
��1��д����ѧʽ��D ��K ��
��2��д���������ӷ���ʽ ��
��3����Ӧ�����������к��ַ�Ӧ���� ������ĸ��ţ���
A�����Ϸ�Ӧ B��������ԭ��Ӧ C�����ӷ�Ӧ D���û���Ӧ
��4����Ҫȷ������Ӧ��������Һ�к���M���ʣ���ѡ�Լ�Ϊ ������ţ���
A��KSCN��Һ����ˮ B�����ۺ�KSCN
C��Ũ��ˮ D�����Ը��������Һ
��5����F���뵽M����Һ�ﲢ¶���ڿ����У����Թ۲쵽�������̵������ǣ�
��
��6�������£�H�������J��Ӧ����Ũ��İ��̣���һ�������ǿ�������Ҫ�ɷ�֮һ����д���÷�Ӧ�Ļ�ѧ����ʽ ��
���𰸡���1��Fe3O4��NH4Cl��2�֣���1�֣�
��2��2Na2O2��2H2O ��4Na+��4OH����O2����2�֣�
��3��D��1�֣���4��D��3�֣�
��5��������ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��2�֣�
��6��8NH3��3Cl2��N2��6NH4Cl��2�֣�
�������������������1�������ͻ�ƿ�Ϊ��Ŀ�������ʵ���ɫ��״̬��������Щ��Ϣ���Ƴ��������ʣ�Ȼ����ݿ�ͼ�Ƴ��������ʡ�A�������������������Ľ�����ΪFe���ڳ�����CΪ��ɫҺ�壬��CΪH2O��BΪ����ɫ��ĩ������H2O��Ӧ����BΪNa2O2��HΪ����ɫ��HΪCl2��J��ʹʪ��ĺ�ɫʯ����ֽ��������JΪNH3�������ͼ�ɵ��������ʣ�DΪFe3O4��EΪH2��FΪNaOH��GΪO2��IΪHCl��KΪNH4Cl��MΪFeCl2��NΪFeCl3��
��2����ΪNa2O2��H2O��Ӧ����NaOH��O2�������ó����ӷ���ʽ��
��3����Ӧ��Ϊ��Cl2+2FeCl2=2FeCl3���÷�Ӧ���ڻ��Ϸ�Ӧ��������ԭ��Ӧ�����ӷ�Ӧ�����������û���Ӧ��
��4����Ӧ��ΪFe3O4��HCl��Ӧ����FeCl2��FeCl3��Ҫ����FeCl2������FeCl2�Ļ�ԭ�ԣ���ʹ����KMnO4��Һ��ɫ���м��顣
��5����NaOH���뵽FeCl2��Һ�У���������Fe(OH)2��Ȼ��Fe(OH)2��O2��H2O��Ӧ����Fe(OH)3���ʷ�Ӧ����Ϊ��������ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��
��6��Cl2�������NH3��Ӧ��������Ũ��İ���ΪNH4Cl����һ�������ǿ�������Ҫ�ɷ֣�ΪN2����ƽ�ɵû�ѧ����ʽ��8NH3��3Cl2��N2��6NH4Cl��

 ����������ϵ�д�
����������ϵ�д� �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�