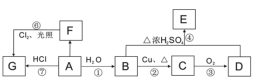
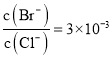题目内容
【题目】如图是一个电化学过程的示意图,请按要求回答下列问题
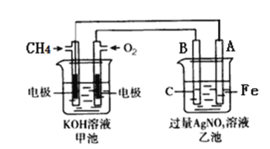
(1)甲池是_______装置(填“原电池”或“电解池”)
(2)写出电极反应式:通入CH4的电极________;A(Fe)电极_______。
(3)反应一段时间后,甲池中消耗1.6g甲烷,则乙池中某电极的质量增加_____g。
(4)反应一段时间后,乙池中溶液成分发生了变化,想要完全恢复到电解前可加入的物质是____
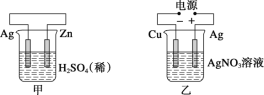
(5)某工厂烟气中主要含SO2,可用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。
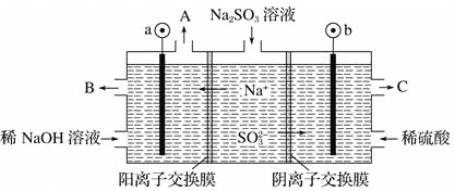
①图中a极要连接电源的______(填“正”或“负”)极,C口流出的物质是______。
②SO32-放电的电极反应式为______。
【答案】原电池 CH4-8e-+10OH-=CO32-+ 7H2O Ag++e-=Ag 86.4g Ag2O 负 较浓的硫酸 SO32--2e-= SO42-+2H+
【解析】
(1)甲池是燃料电池,将化学能转化为电能,属于原电池;
(2)燃料电池中甲烷失电子,发生氧化反应,注意还要考虑电解质的后续反应,故电极反应式为:CH4-8e-+10OH- =CO32-+ 7H2O,铁与电源负极相连作阴极,溶液中银离子在阴极A得电子发生还原反应,电极反应式为:Ag++e- =Ag;
(3)甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4-8e-+10OH-=CO32-+ 7H2O,消耗1.6g甲烷的物质的量为0.1mol,转移电子0.8mol,根据Ag++e-=Ag,乙池阴极增重银的质量为:0.8mol×108g/mol=86.4g;
(4)乙池电池反应式为4AgNO3+2H2O=4Ag+O2↑+4HNO3,向溶液中加入氧化银,氧化银与硝酸反应又生成硝酸银和水,可使溶液恢复到电解前的状况;
(5)①由图可知,Na+移向a极,所以a极为阴极,连接电源负极,b极为阳极,连接电源负极,SO32-失电子,发生氧化反应生成SO42-,所以C口流出较浓的硫酸;
②SO32-在阳极放电,发生氧化反应生成硫酸根,电极反应式为:SO32--2e-= SO42-+2H+。

【题目】下列有关叙述不正确的是![]()
选项 | 已知 | 解释与结论 |
A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
B |
该反应在常温下能自发进行 | 该反应的 |
C | 常温下,
| 向 |
D | 向 | 氧化性: |
A.AB.BC.CD.D
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
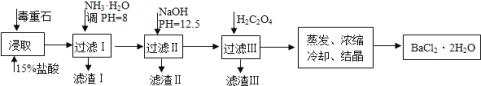
(1)写出“浸取”环节发生的主要离子方程式______。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的______。(双选,填选项字母)
a.烧杯b.容量瓶c.滴定管d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图
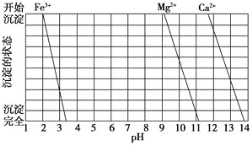
已知:Ksp(BaC2O4)= 1.6×10-7, Ksp(CaC2O4)= 2.3×10-9,
①滤渣I中含_____(填化学式)。再加入NaOH调节pH=12.5可除去______(填离子符号)
②加入H2C2O4应避免过量的原因是________
(3)25℃,H2C2O4的电离平衡常数如下:
H2C2O4 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
①HC2O4-的电离平衡常数表达式Ka2=__________
②NaHC2O4溶液呈_______(酸性、碱性、中性)
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是( )
A.升温不利于正反应生成Ni(CO)4(g)
B.在25 ℃时,反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正>v逆
D.在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1