题目内容
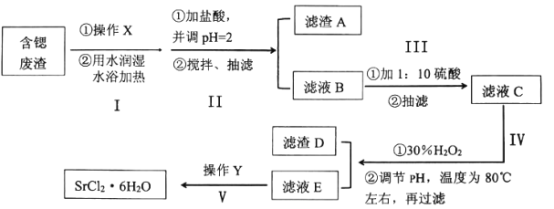
【题目】工业上可以用天青石生产碳酸锶后的含锶废渣制备高纯六水氯化锶(SrCl26H2O),含锶废渣主要成分为SrCO3,且含钡、铁、钙等元素。六水氯化锶是一种无色长针状晶体,易溶于水,微溶于无水乙醇和丙酮,下面为实验室模拟SrCl26H2O的制作流程:
已知:①SrSO4微溶于水;
②SrCl26H2O在61.5℃以上即会失去4个结晶水生成SrCl22H2O。
(1)关于上述实验操作下列说法不正确的是___。
A.步骤I中操作X为研磨粉碎,可以增大反应接触面积
B.步骤III为提高产率,可以用滤液淋洗布氏漏斗中的滤渣
C.抽滤时,如果溶液有强酸性,可以用玻璃纤维代替滤纸
D.减压过滤不宜过滤胶状沉淀,因为胶状沉淀会在滤纸上形成一层密实的沉淀
E.步骤IV中的温度控制在80℃左右,可以用水浴加热,也可以用油浴或砂浴加热代替,更安全
(2)下表为实验中硫酸加入量对溶液中Ba2+和Sr2+含量的影响,实验发现在步骤III中加入硫酸量过量20%较合适,请解释原因:___。
硫酸加入量/mL | 4.50 | 4.95 | 5.40 | 5.85 | 6.30 |
Ba2+/(g/L) | 0.37 | 0.21 | 0.13 | 0.11 | 0.10 |
Sr2+/(g/L) | 90.21 | 89.86 | 89.57 | 89.23 | 88.90 |
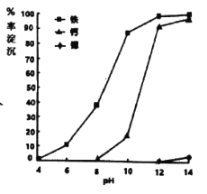
(3)①步骤IV调节pH时,为避免引入新的杂质,最适宜加入的试剂为___,如图为在80℃时,pH对除杂的影响,通过加入试剂将pH调至___。
②往滤渣D中加入NaClO溶液,发生反应的离子方程式为:___。
(4)在步骤V中,若要从滤液E通过操作Y得到大颗粒的高纯六水氯化锶晶体,操作Y包含下列步骤中的某几项,请选择合适的操作并排序。(填相应步骤的字母)
滤液E→(_____)→(_____)→(_____)→抽滤→(_____)→(_____)
a.蒸发浓缩至有大量晶体析出
b.在过饱和溶液中加入晶种
c.6l.5℃以上减压蒸发浓缩
d.6l.5℃以下减压蒸发浓缩
e.往溶液中加入无水乙醇
f.在30℃真空烘箱中干燥
g.在室温下缓慢冷却结晶
h.用氯化锶饱和溶液洗涤晶体
I.用冷水洗涤晶体
(5)为侧定所制SrCl26H2O晶体的纯度,取1.12g实验制得的产物加水溶解,配成100mL溶液,用移液管取出25mL于锥形瓶中,滴入几滴K2CrO4
①判断滴定终点的现象为___;
②实验时未采用棕色滴定管滴定,会使测得的晶体纯度___(填“偏高”、“偏低”或“不变”)。
【答案】BDE 硫酸量过量20%可以使Ba2+沉淀完全,但是过量太多会使Sr2+沉淀 Sr(OH)2或SrO 12 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O d b g h f 滴入最后一滴时,锥形瓶中出现砖红色沉淀,且半分钟内不变色 偏高
【解析】
含锶废渣(主要成分为SrCO3,且含钡、铁、钙等元素)研磨粉碎,再加水润湿后水浴加热,加入足量的盐酸并搅拌,调节pH=2进行酸浸溶解,充分酸溶后的溶液进行抽滤,得到不与盐酸反应的杂质滤渣A和滤液B,滤液B中主要含有Sr2+、Ba2+、Fe2+、Ca2+、Cl-的酸性溶液,向滤液B中按体积比1:10加入足量硫酸,是滤液B中的Ba2+全部转化为BaSO4沉淀除去,在进行抽滤得到滤液C,对滤液C加入30%双氧水,将滤液C中的Fe2+氧化为Fe3+,为避免引入新的杂质,加入Sr(OH)2或SrO,调节pH值,使Fe3+、Ca2+ 转化为Ca(OH)2、Fe(OH)3沉淀除去,将滤液加热至80℃左右,再过滤,得到的滤渣D为Ca(OH)2、Fe(OH)3,滤液E中主要含有Sr2+、Cl-,由于SrCl26H2O在61.5℃以上即会失去4个结晶水生成SrCl22H2O,则对滤液E进行减压蒸发浓缩,过滤、洗涤、干燥,得到产品SrCl26H2O,据此分析解答。
(1)A.步骤I中操作X为研磨粉碎,可以增大反应接触面积,故A正确;
B.步骤III为得到滤液C,抽滤除去的滤渣,若用滤液淋洗滤渣不能将滤渣中吸附的溶质洗涤下来的,故B错误;
C.玻璃纤维中含有二氧化硅,在碱性条件下易被腐蚀,与酸不反应,则抽滤时,如果溶液有强酸性,可以用玻璃纤维代替滤纸,故C正确;
D.减压过滤不宜过滤胶状沉淀,因为胶状沉淀会透过滤纸,故D错误;
E.步骤IV中油浴若外溢易失火,从实验安全考虑,且不适合明火加热,水浴更安全,故E错误;
答案为BDE;
(2)硫酸锶的溶度积远远大于硫酸钡的溶度积,但因为溶液中大部分是氯化锶,所以加入硫酸后会先生成硫酸锶,而硫酸锶微溶于水的特性使其进一步转化成硫酸钡的反应速度较慢,为缩短反应时间且使Ba2+沉淀完全可适量多加硫酸,但是过量太多又会使Sr2+沉淀。因此答案为:硫酸量过量20%可以使Ba2+沉淀完全,但是过量太多会使Sr2+沉淀;
(3)①步骤IV调节pH时,为避免引入新的杂质,最适宜加入的试剂为Sr(OH)2或SrO,根据图像,将pH调至12,可以使铁和钙沉淀较完全,而锶几乎未沉淀;
②滤渣D主要成分为Ca(OH)2、Fe(OH)3,滤渣D中加入NaClO溶液,发生反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(4)在步骤V中,若要从滤液E通过操作Y得到大颗粒的高纯六水氯化锶晶体,先在61.5℃以下减压蒸发浓缩,在过饱和溶液中加入晶种,然后在室温下缓慢冷却结晶,再抽滤。如果用往溶液中加入无水乙醇,醇析的方法析出晶体,需要缓慢加入才会析出大颗粒晶体,抽滤后用氯化锶饱和溶液洗涤晶体更能减少产品的溶解,为防止晶体失去结晶水,在30℃真空烘箱中干燥,则操作顺序为:滤液E→d→b→g→抽滤→h→f;
(5)①此方法为沉淀滴定法,滴定开始为白色沉淀,由于Ag2CrO4为砖红色沉淀,因此判断滴定终点的现象为:锥形瓶中沉淀颜色由白色变为砖红色,且半分钟不变色;
②若硝酸银标准液未采用棕色滴定管滴定,硝酸银见光会分解,标准液用量偏多,会使测得的晶体纯度偏高。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案