题目内容
【题目】已知N2(g)+3H2(g)2NH3(g);△H=﹣92.4kJmol﹣1 . 请回答: 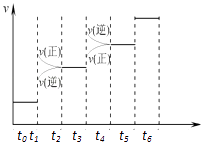
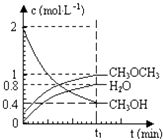
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中tl时引起平衡移动的条件可能是 . 其中表示平衡混合物中NH3的含量最高的一段时是 .
(2)温度为T℃时,将2mol H2和1mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则平衡时 H2的浓度 .
(3)当温度升高时,反应的化学平衡常数K值(增大、减小、无影响).
(4)已知单质硫的燃烧热为296kJmol﹣1 , 写出其燃烧的燃烧热方程式: .
(5)已知中和热为57.3kJmol﹣1 , 写出NaOH和H2SO4反应的热化学方程式: .
【答案】
(1)增大压强;t2﹣t3
(2)1mol/L
(3)减小
(4)S(s)+O2(g)=SO2(g)△H=﹣296kJ?mol﹣1
(5)![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol
Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol
【解析】解:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol;反应是放热反应,反应前后气体体积减小,
(1.)由反应速率与时间关系图象可知,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;t3时刻正逆反应速率均迅速增大,但是平衡逆向进行,所以氨气的百分含量是减小的,即表示平衡混合物中NH3的含量最高的一段时间是t2﹣t3 ,
所以答案是:增大压强;t2﹣t3;
(2.)
N2(g) | + | 3H2(g) | 2NH2(g) | ||
开始 | 2mol/L | 4mol/L | 0 | ||
反应 | 1mol/L | 3mol/L | 2mol/L | ||
平衡 | 1mol/L | 1mol/L | 2mol/L |
平衡时氢气浓度=1mol/L,
所以答案是:1mol/L;
(3.)已知N2(g)+3H2(g)2NH3(g);△H=﹣92.4kJmol﹣1 , 反应是放热反应,升温平衡逆向进行,平衡常数减小,
所以答案是:减小;
(4.)单质硫的燃烧热为296KJmol﹣1 , 所以热化学方程式为:S(s)+O2(g)═SO2(g)△H=﹣296kJ/mol,
所以答案是:S(s)+O2(g)=SO2(g)△H=﹣296kJmol﹣1;
(5.)HCl和NaOH反应的中和热△H=﹣57.3kJmol﹣1 , H2SO4和NaOH反应的中和热是指反应生成1mol水放出57.3kJ的热量,反应的热化学方程式为 ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol,所以答案是:
Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol,所以答案是: ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol.
Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.

 名校课堂系列答案
名校课堂系列答案