题目内容
12.某种元素的一种同位素${\;}_{Z}^{A}$X,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应,若这种同位素原子核内有20个中子,则:(1)Z值为20.
(2)X元素在周期表中的位置为第四周期第ⅡA族.
分析 根据Cl-+Ag+═AgCl↓计算XCl2的物质的量,再根据M=$\frac{m}{n}$计算其摩尔质量,进而计算X的相对分子质量,原子的质量数为原子的近似相对原子质量,根据质子数=质量数-中子数来计算X原子的质子数,利用质子数确定元素在周期表中的位置.
解答 解:(1)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,
n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.02mol=0.01mol,
则M(XCl2)=$\frac{1.1g}{0.01mol}$=111g/mol,
所以XCl2相对分子质量为111,
所以X的相对原子质量=111-35.5×2=40,即X的质量数为40,
质子数=质量数-中子数=40-20=20,
故答案为:20;
(2)X为Ca,位于第四周期第ⅡA族,故答案为:第四周期第ⅡA族.
点评 本题考查反应方程式的计算、结构与位置关系等,难度不大,注重对基础知识的理解掌握.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
2.已知aAn+,bB(n+1)+,cCn-,dD(n+1)-是具有相同的电子层结构的短周期元素形成的简单离子,下列叙述正确的是( )
| A. | 最外层电子数:C>D>A>B | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:Cn->D(n+1)->An+>B(n+1)+ | D. | 单质还原性:B>A>C>D |
3.NA是阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.00mol NaCl中含有NA个NaCl分子 | |
| B. | 1.00mol NaCl中,所有Na+的最外层电子总数为8NA | |
| C. | 欲配制1.00L,1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 标准状况下,11.2LCH3CH2OH中含有分子的数目为0.5NA |
20.氰气[(CN)2]和氰化物都是剧毒性物质,氰分子的结构式为N≡C-C≡N,性质与卤素相似,下列叙述错误的是( )
| A. | 氰分子中四原子共直线 | |
| B. | 氰分子中C≡N键长大于C≡C键长 | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰化氢在一定条件下能与烯烃发生加成反应 |
17.下列各组中两种物质在水溶液中的反应,可用同一离子方程式表示的是( )
| A. | NaHCO3+HNO3;Na2CO3+HCl | B. | Cu(OH)2+HCl;Cu(OH)2+CH3COOH | ||
| C. | NaOH+H2SO4;KOH+NaHSO4 | D. | Na2CO3+HCl(少量);Na2CO3(少量)+HCl |
4.汽车尾气中的氮氧化物(NOx)是大气的污染物,不仅可直接导致动植物中毒而且会参与酸雨及光化学烟雾的形成,所以要尽可能的消除.消除方法之一是在汽车排气管中装上催化转化器,利用反应:4xNH3+6NOx═(2x+3)N2+6xH2O使氮氧化物转化为无害物质,在该反应中还原剂与转移电子的数目关系中正确的是( )
| A. | NH3(12e-) | B. | NOx(12e-) | C. | NH3(12xe-) | D. | NOx(12xe-) |
2.一定温度下,在三个体积均为1L的密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).下列说法正确的是( )
| 实验编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | ||
| ① | 430 | 1 | 1 | 0.95 | 0.95 |
| ② | 830 | 1 | 1 | 0.5 | 0.5 |
| ③ | 830 | 1.5 | 1 | ||
| A. | 正反应的△H>0 | B. | CO转化率③>② | ||
| C. | 实验①达到平衡的时间比②短 | D. | 430℃时,该反应的平衡常数为361 |
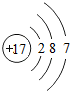 ;
; ,该化合物的水溶液在空气中久置后变质,生成一种单质和一种强碱,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目:
,该化合物的水溶液在空气中久置后变质,生成一种单质和一种强碱,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目: