题目内容
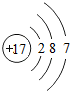
7.有A,B,C,D,E五种短周期元素(稀有气体除外),原子序数依次增大,其中只有C为金属元素,A,C原子序数之和等于E的原子序数,D与B同主族且D的原子序数是B的原子序数的2倍,AB2和DB2溶于水得到酸性溶液,常见化合物C2B2与水反应生成的B单质,且溶液使酚酞试液变红.(1)E元素的原子结构示意图为
 ;
;(2)A,D,E三种元素最高价氧化物的水化物的酸性由强到弱的顺序为:HClO4>H2SO4>H2CO3
(3)在低温下,将E的单质通入饱和NaHCO3溶液中,反应后得到一种微绿色气体E2B,CE和另一种无色气体,则该反应中E2B,CE这两种产物的物质的量之比n(E2B):n(CE)=1:2,已知E2B溶于水生成一种具有漂白性的弱酸,该弱酸分子的结构式为H-O-Cl
(4)化合物C2D3中,各原子(或离子)最外层均达到8电子稳定结构,则C2D3的电子式为
 ,该化合物的水溶液在空气中久置后变质,生成一种单质和一种强碱,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目:
,该化合物的水溶液在空气中久置后变质,生成一种单质和一种强碱,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目: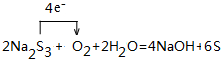
(5)用A的最低负价氢化物,氧气,KOH溶液组成燃料电池,则负极反应式为CH4-8e-+10OH-═CO32-+7H2O,溶液中的OH-移向原电池的负(填“正”或“负”)极.
分析 A,B,C,D,E五种短周期元素(稀有气体除外),原子序数依次增大,其中只有C为金属元素,化合物C2B2与水反应生成的B单质,且溶液使酚酞试液变红,说明溶液呈碱性,该反应为过氧化钠与水反应生成氧气和氢氧化钠,则C为Na,B为O,D与B同主族且D的原子序数是B的原子序数的2倍,则D为S,AB2和DB2溶于水得到酸性溶液,则A为C元素,A,C原子序数之和等于E的原子序数,则E为Cl,据此答题.
解答 解:A,B,C,D,E五种短周期元素(稀有气体除外),原子序数依次增大,其中只有C为金属元素,化合物C2B2与水反应生成的B单质,且溶液使酚酞试液变红,说明溶液呈碱性,该反应为过氧化钠与水反应生成氧气和氢氧化钠,则C为Na,B为O,D与B同主族且D的原子序数是B的原子序数的2倍,则D为S,AB2和DB2溶于水得到酸性溶液,则A为C元素,A,C原子序数之和等于E的原子序数,则E为Cl,
(1)E为Cl,原子结构示意图为 ,
,
故答案为: ;
;
(2)元素非金属性越强,最高价氧化物的水化物的酸性越强,C、S、Cl中,非金属性的强弱顺序为Cl>S>C,所以三种元素最高价氧化物的水化物的酸性由强到弱的顺序为:HClO4>H2SO4>H2CO3,
故答案为:HClO4>H2SO4>H2CO3;
(3)在低温下,将Cl2通入饱和NaHCO3溶液中,反应后得到一种微绿色气体Cl2O,NaCl和另一种无色气体应为CO2,反应的方程式为2Cl2+2NaHCO3=Cl2O+2NaCl+H2O+2CO2,所以该反应中Cl2O、NaCl的物质的量之比n(Cl2O):n(NaCl)=1:2,Cl2O溶于水生成一种具有漂白性的弱酸为次氯酸,该弱酸分子的结构式为H-O-Cl,
故答案为:1:2;H-O-Cl;
(4)化合物Na2S3中,各原子(或离子)最外层均达到8电子稳定结构,则Na2S3的电子式为  ,Na2S3的水溶液在空气中久置后变质,生成硫和氢氧化钠,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目为
,Na2S3的水溶液在空气中久置后变质,生成硫和氢氧化钠,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目为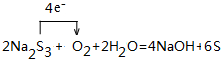 ,
,
故答案为: ;
;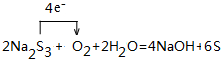 ;
;
(5)用甲烷、氧气、KOH溶液组成燃料电池,甲烷是还原剂,在负极发生氧化反应,氧气是氧化剂,在正极发生还原反应,则负极反应式为CH4-8e-+10OH-═CO32-+7H2O,根据原子电池电路是一个闭合回路可知,溶液中的OH-移向原电池的负极,
故答案为:CH4-8e-+10OH-═CO32-+7H2O;负.
点评 本题考查元素的推断,题目难度不大,本题从物质的性质的角度入手考查元素的种类,注意常见元素化合物的性质,注意电子式和电极反应式的书写.

 阅读快车系列答案
阅读快车系列答案| A. | 分离KNO3和氯化钠,常用结晶与重结晶 | |
| B. | 分离溴苯和水,常用蒸馏法 | |
| C. | 提纯含有碘的食盐,常用升华法 | |
| D. | 苯和酸性高锰酸钾溶液可用分液法 |
| A. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | ||||||||
| B. | AlCl3溶液与烧碱溶液反应,当 n(OH-):n(Al3+ )=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||||||
| C. | 钠与CuSO4溶液反应,2Na+Cu2+═Cu↓+2Na+ | ||||||||
| D. | 已知碳酸和次氯酸的电离平衡常数如下:
|
| A. | 硫酸盐 | B. | 铵盐 | C. | 正盐 | D. | 酸式盐 |
①x+m;②x-m;③x+n;④x-n.
| A. | ②③ | B. | ①④ | C. | ①③ | D. | 全部 |
| A. | 石油经过分馏及裂化等方法得到的物质均为纯净物 | |
| B. | 用氢氧化钠溶液可以除去乙酸乙酯中混有的乙酸、乙醇杂质 | |
| C. | 化合物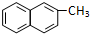 是苯的同系物 是苯的同系物 | |
| D. | 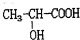 在一定条件下可以发生缩聚反应生成聚合物 在一定条件下可以发生缩聚反应生成聚合物 |
 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) .
.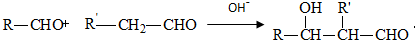 .有机物G(C20H18O4)是一种酯,合成路线如下:
.有机物G(C20H18O4)是一种酯,合成路线如下: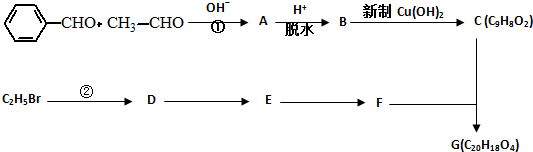
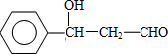 ;F的结构简式:CH2OHCH2OH;
;F的结构简式:CH2OHCH2OH; .
.