题目内容
3.(1)中学常见的某有色物质,全部由短周期元素组成,能与水发生氧化还原反应,但反应中水既不作氧化剂也不作还原剂.试写出符合条件的两种物质(写化学式)NO2、Cl2.(2)在一定条件下,RO3n- 和I-发生反应,离子方程式为:RO3n-+6I-+6H+═R-+3I2+3H2O,RO3n-中R元素的化合价为+5,R元素的原子最外层电子有7个.
利用I2的氧化性可测定钢铁中硫的含量.做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为淀粉溶液,该滴定反应的离子方程式为H2SO3+I2+H2O=4H++SO42-+2I-.
分析 (1)全部由短周期元素组成的物质,是中学化学常见的有色物质,均能与水发生氧化还原反应,但反应中水既不作氧化剂也不作还原剂,分别为NO2、Cl2以及Na2O2等;
(2)根据电荷守恒知,RO3n-+3S2-+6H+=R-+3S+3H2O中n=1,离子中各元素化合价的代数和等于电荷数,据此判断R元素化合价;主族元素原子,最外层电子数=最高正化合价,最低负价=族序数-8;因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂;根据氧化还原反应书写化学方程式.
解答 解:(1)全部由短周期元素组成的物质,是中学化学常见的有色物质,均能与水发生氧化还原反应,但反应中水既不作氧化剂也不作还原剂,分别为NO2、Cl2以及Na2O2等;
故答案为:NO2;Cl2;
(2)根据电荷守恒知,RO3n-+3S2-+6H+=R-+3S+3H2O中n=1,离子中各元素化合价的代数和等于电荷数,所以RO3-中化合价-1-(-2)×3=+5;
R元素最低化合价为-1价,则其最高化合价为+7价,主族元素原子,最外层电子数=最高正化合价=7;
因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂,滴定终点时溶液的颜色变化为无色变为蓝色,反应的离子方程式为H2SO3+I2+H2O=4H++SO42-+2I-;
故答案为:+5;7;淀粉溶液;H2SO3+I2+H2O=4H++SO42-+2I-.
点评 本题考查氧化还原反应以及滴定实验,侧重考查基本概念、基本理论,注意不能根据方程式RO3-中R元素化合价判断最外层电子数,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.二十世纪化学合成技术的发展对人类健康水平和生活质量的提高做出了巨大贡献.下列各组物质全部由化学合成得到的是( )
| A. | 玻璃 纤维素 青霉素 | B. | 石英 橡胶 磷化铟尿素 | ||
| C. | 食盐 聚乙烯 | D. | 涤纶 洗衣粉 阿司匹林 |
18.下列说法正确的是( )
| A. | 石油经过分馏及裂化等方法得到的物质均为纯净物 | |
| B. | 用氢氧化钠溶液可以除去乙酸乙酯中混有的乙酸、乙醇杂质 | |
| C. | 化合物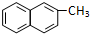 是苯的同系物 是苯的同系物 | |
| D. | 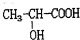 在一定条件下可以发生缩聚反应生成聚合物 在一定条件下可以发生缩聚反应生成聚合物 |
8.如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,不正确的是( )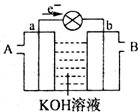

| A. | b电极上发生还原反应 | |
| B. | a电极的电极反应式为:CO+4OH-+2e-═CO32-+2H2O | |
| C. | B处通入的是空气 | |
| D. | 溶液中的K+向b电极方向移动 |
15.生活中常常碰到涉及化学知识的某些问题,下列叙述错误的是( )
| A. | 人的皮肤在强紫外线的照射下将会失去生理活性 | |
| B. | 常用新制的氢氧化铜检验司机酒后驾车 | |
| C. | 棉花和木材的主要成分都是纤维素 | |
| D. | 蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水 |
12.下列说法不正确的是( )
| A. | 葡萄糖能够发生银镜反应 | |
| B. | 米酒变酸的过程涉及了氧化反应 | |
| C. | 漂白液的有效成分是NaClO,可用于杀菌消毒 | |
| D. | 光导纤维、棉花、油脂、树脂都是由高分子化合物组成的物质 |
13.下列反应必须用稀硫酸,而不能用浓硫酸的是( )
| A. | 用纤维素制硝化纤维 | B. | 跟苯、浓硝酸作用制硝基苯 | ||
| C. | 溶解金属铜 | D. | 锌与酸制氢气 |