题目内容
在酸性溶液中,下列离子组在溶液中能大量共存的是
| A.Cu2+、NH4+、Br-、OH- | B.K+、Ba2+、OH-、SO42- |
| C.Ag+、NO3-、Cl-、K+ | D.Cl-、SO42-、K+、Na+ |
D
解析试题分析:A、酸性条件下H+和OH—反应生成水,不能大量共存,错误;B、酸性条件下H+和OH—反应生成水,Ba2+和SO42-反应生成硫酸钡沉淀,不能大量共存,错误;C、酸性溶液中,Ag+和Cl-反应生成氯化银沉淀,不能大量共存,错误;D、给定条件下组内离子间不反应,能大量共存,正确。
考点:考查离子大量共存问题。

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
在下列各溶液中,离子一定能大量共存的是
| A.强酸性溶液中:K+、Al3+、CH3COO-、SO42- |
B.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO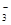 、Br-、Ba2+ 、Br-、Ba2+ |
| C.室温下,pH=1的无色溶液中:NH4+、Mg2+、SO42-、Cl- |
| D.室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42- |
在下列条件的溶液中,各组离子一定能够大量共存的是
| A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+ |
| B.水玻璃溶液中:K+、SO42-、Cl-、H+ |
| C.可与Al反应放出氢气的溶液中:Na+、Ca2+、Cl-、HCO3- |
| D.使石蕊变蓝的溶液中:Ba2+、Na+、AlO2-、Cl- |
下列反应的离子方程式正确的是
| A.铜溶于浓硝酸:Cu + 4H+ + 2NO3-= Cu2+ + 2NO2↑+ 2H2O |
| B.氯化铝溶液与过量氨水反应:Al3++4NH3·H2O= [Al(OH)4]-+4NH4+ |
| C.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| D.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
下列离子方程式中正确的是
A.用Pt电极电解少量的CuCl2溶液:2H2O+Cu2++2Cl- H2↑+Cl2↑+Cu(OH)2↓ H2↑+Cl2↑+Cu(OH)2↓ |
| B.0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| C.酸性高锰酸钾溶液中滴加H2O2溶液4H2O2+ 4MnO4-+ 12H+ =" 4" Mn2+ + 10 H2O + 7O2↑ |
| D.向磁性氧化铁中加入氢碘酸:Fe3O4 +8H+=Fe2+ +2 Fe3+ +4H2O |
下列方程式不正确的是
| A.用稀H2SO4吸收氨气:NH3+H+=NH4+ |
| B.少量的CO2通入NaOH溶液中:CO2+2OH-=CO32-+H2O |
| C.铜溶解于氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| D.足量铁溶于稀硝酸,溶液变成浅绿色:Fe+4H++NO3-=Fe3++NO↑+2H2O |
下列离子方程式中,正确的是
| A.稀硫酸滴在铁片上:2Fe + 6H+=2Fe3+ + 3H2 |
| B.氧化镁与稀盐酸混合:MgO + 2H+=Mg2+ + H2O |
| C.铜片插入硝酸银溶液中:Cu + Ag+=Cu2+ + Ag |
| D.氯气通人水中:Cl2+H2O=2H++Cl-+ Cl0- |
如图,将2 mL浓度为6 mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失。对该反应过程的推断不合理的是: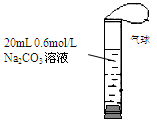
| A.有反应CO32- + 2H+ → CO2↑ + H2O发生 |
| B.有反应CO32- + H+ → HCO3-发生 |
| C.有反应CO32- + CO2 + H2O→ 2HCO3-发生 |
| D.加快盐酸注入速度不会改变反应现象 |