题目内容
20.氧元素的氢化物除H2O外,还有H2O2,其电子式为 ;碳元素的氢化物除CH4外,还有C2H6;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为N2H4,其沸点比氨气高(填“高”或“低”),该氢化物与足量盐酸反应的化学反应方程式为N2H4+2HCl=N2H6Cl2.
;碳元素的氢化物除CH4外,还有C2H6;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为N2H4,其沸点比氨气高(填“高”或“低”),该氢化物与足量盐酸反应的化学反应方程式为N2H4+2HCl=N2H6Cl2.
分析 H2O2中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;依据信息结合常识判断含2个氮原子的分子为肼;与氨气都属于分子晶体,相对分子质量越大,熔沸点越大,依据相对分子质量大小判断其熔沸点,然后书写化学反应方程式即可.
解答 解:H2O2为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,含2个氮原子的分子为肼,化学式为N2H4;与氨气都属于分子晶体,相对分子质量越大,熔沸点越大,由于其相对分子质量较氨气大,故熔沸点比氨气高,肼与HCl反应方程式为N2H4+2HCl=N2H6Cl2,
,含2个氮原子的分子为肼,化学式为N2H4;与氨气都属于分子晶体,相对分子质量越大,熔沸点越大,由于其相对分子质量较氨气大,故熔沸点比氨气高,肼与HCl反应方程式为N2H4+2HCl=N2H6Cl2,
故答案为: ;N2H4; 高; N2H4+2HCl=N2H6Cl2.
;N2H4; 高; N2H4+2HCl=N2H6Cl2.
点评 本题主要考查的是氧、氮元素及其化合物的结构、性质、熔沸点的比较,方程式的书写,侧重于考查学生对基础知识的综合应用能力,注意根据题干信息判断含2个氮原子的分子为肼是解答关键,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
10.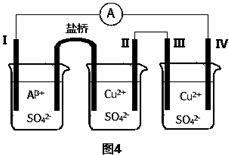 某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )
某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )
 某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )
某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )| A. | 电流方向:电极Ⅳ→A→电极Ⅰ | B. | 电极Ⅰ发生还原反应 | ||
| C. | 电极Ⅱ逐渐溶解 | D. | 电极Ⅲ的电极反应:Cu2++2e-=Cu |
11.下列有关周期表的说法中,正确的是( )
| A. | 每个主族都含有非金属元素 | B. | 构成半导体的元素都是非金属元素 | ||
| C. | 过渡元素都属于金属元素 | D. | 非金属元素都位于短周期 |
8.图表示的是某物质所发生的( )


| A. | 置换反应 | B. | 电离过程 | C. | 中和反应 | D. | 水解反应 |
5.工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出.下列说法错误的是( )
| A. | 氧化性:H2SeO4>Cl2;H2SeO3>H2SO4 | |
| B. | 酸性:H2SO4>H2SeO4>H2SeO3 | |
| C. | 析出l mol硒需要消耗标准状况下22.4 L SO2 | |
| D. | 亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸 |
9.关于化学反应速率的说法正确的是( )
| A. | 化学反应速率可表示可逆反应进行的程度 | |
| B. | 化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加 | |
| C. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 | |
| D. | 根据反应速率的大小可知化学反应进行的相对快慢 |
10.M+N=Y+Z为吸热反应,对这个反应的下列说法中正确的是( )
| A. | X的能量一定低于M的,Y的能量一定低于N的 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | Z和Y的总能量一定高于M和N的总能量 |
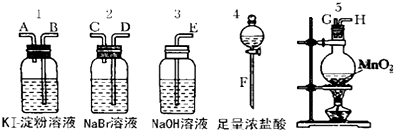
 研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.
研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.