题目内容
9.关于化学反应速率的说法正确的是( )| A. | 化学反应速率可表示可逆反应进行的程度 | |
| B. | 化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加 | |
| C. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 | |
| D. | 根据反应速率的大小可知化学反应进行的相对快慢 |
分析 A、化学反应速率可表示可逆反应进行的快慢;
B、固体和纯液体不能表示反应速率;
C、有些反应无反应现象;
D、化学反应速率的大小是衡量反应快慢的物理量;
解答 解:A、化学反应速率可表示可逆反应进行的快慢,平衡常数表示反应进行的程度,故A错误;
B、反应中固体和纯液体不能表示反应速率,故B错误;
C、有些反应无反应现象,如酸碱中和反应,盐酸和氢氧化钠溶液反应瞬间进行速率大,但反应现象不明显,故C错误;
D、化学反应速率的大小是衡量反应快慢的物理量,根据化学反应速率的大小可知化学反应进行的快慢,故D正确;
故选D.
点评 本题考查了化学反应速率概念的分析判断,注意速率计算的方法应用,反应现象和反应快慢无直接关系,题目较简单.

练习册系列答案
相关题目
19.一种新型净水剂PAFC{聚合氯化铁铝,[AlFe(OH)nCl6-n]m,n<5,m<10},广泛用于生活用水的净化和废水的净化,有关PAFC的说法正确的是( )
| A. | PAFC用于净化饮用水时,可以除去水中所有的有害物质 | |
| B. | PAFC中铁显+2价 | |
| C. | PAFC可溶于盐酸溶液 | |
| D. | PAFC没有氧化性 |
17.下列同族元素的单质,在相同条件下最易与水反应的是( )
| A. | Li | B. | Na | C. | K | D. | Rb |
4.根据下表信息回答以下问题(均为短周期元素):
(1)在下表中用元素符号标出A、B、C、F的位置
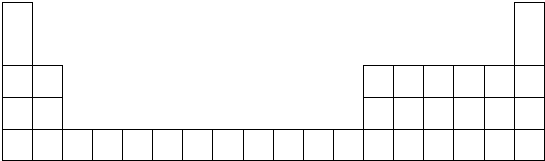
(2)C、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Be(OH)2+2H+═Be2++2H2O.
(3)F在E中燃烧的化学反应方程式:4Li+O22Li2O
(4)设计简单试管实验证明D元素与H元素的非金属性强弱关系:将氯水滴入硫化钠溶液中,若有淡黄色沉淀生成可证明氯气氧化性大于S,从而证明非金属性Cl>S.
| 元素 | A | B | C | D | E | F | G | H |
| 原子半径(nm) | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 | 0.152 | 0.037 | 0.099 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1,-1 | +7,-1 |

(2)C、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Be(OH)2+2H+═Be2++2H2O.
(3)F在E中燃烧的化学反应方程式:4Li+O22Li2O
(4)设计简单试管实验证明D元素与H元素的非金属性强弱关系:将氯水滴入硫化钠溶液中,若有淡黄色沉淀生成可证明氯气氧化性大于S,从而证明非金属性Cl>S.
14.下列说法正确的是( )
| A. | 通过测同温同浓度下的Na2CO3和Na2SO3水溶液的pH可以确定碳和硫两元素非金属性强弱 | |
| B. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| C. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性 | |
| D. | 总质量一定时,甲醛和乙酸无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 |
1.下列说法正确的是( )
| A. | 氢键不是化学键 | |
| B. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 乙醇分子与水分子之间只存在范德华力 | |
| D. | 碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
18.CH2=C(CH3)-COOH,它不可能具有的性质是( )
| A. | 使酸性高锰酸钾溶液褪色 | B. | 发生加聚反应 | ||
| C. | 与银氨溶液反应 | D. | 与纯碱反应 |
2.在NH3•H2O?NH4++OH-形成的平衡中,要使NH3•H2O的电离程度及[OH-]都增大,可采取的措施是( )
| A. | 通入HCl | B. | 加少量NaOH固体 | C. | 加水 | D. | 升温 |

 ;碳元素的氢化物除CH4外,还有C2H6;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为N2H4,其沸点比氨气高(填“高”或“低”),该氢化物与足量盐酸反应的化学反应方程式为N2H4+2HCl=N2H6Cl2.
;碳元素的氢化物除CH4外,还有C2H6;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为N2H4,其沸点比氨气高(填“高”或“低”),该氢化物与足量盐酸反应的化学反应方程式为N2H4+2HCl=N2H6Cl2.