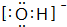题目内容
11.常温下,下列溶液的离子浓度关系正确的是( )| A. | pH=4的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-4mol/L | |
| B. | pH=x的CH3COOH溶液100mL,稀释10倍后pH=y,x-y>1 | |
| C. | pH=2的NaHC2O4溶液与pH=12的NaOH溶液以任意比混合,混合液中:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | pH相同的①CH3COONa、②Na2CO3 、③NaClO三种溶液中c(Na+):①>②>③ |
分析 A.任何电解质溶液中都存在电荷守恒,根电荷守恒判断;
B.乙酸是弱电解质,加水稀释促进弱电解质电离;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.弱酸根离子水解程度越大,pH相同的钠盐溶液浓度越小.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故A错误;
B.乙酸是弱电解质,加水稀释促进弱电解质电离,所以醋酸溶液稀释10倍后,氢离子浓度大于原来的$\frac{1}{10}$,所以pH=x的CH3COOH溶液100mL,稀释10倍后pH=y,x-y>-1,故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故C正确;
D.弱酸根离子水解程度越大,pH相同的钠盐溶液浓度越小,酸根离子水解程度CO32->ClO->CH3COO-,所以pH相同的①CH3COONa、②Na2CO3 、③NaClO三种溶液中c(Na+):①>③>②,故D错误.
故选C.
点评 本题考查离子浓度大小比较,为高考高频点,明确溶液中溶质及其性质是解本题关键,知道弱电解质电离特点,注意结合电荷守恒、物料守恒分析,易错选项是D.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.分析下列各项结构的规律,按此规律排布第10项的分子式应为( )
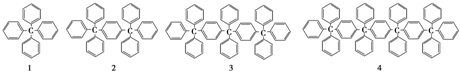

| A. | C198H146 | B. | C196H155 | C. | C196H146 | D. | C198H155 |
2.黑火药在适当的外界能量作用下,能进行迅速而有规律的燃烧,瞬间产生大量的热和氮气、二氧化碳等气体,由于体积急剧膨胀,压力猛烈增大,于是发生了爆炸.反应方程式为S+2KNO3+3C═K2S+N2↑+3CO2↑,下列说法不正确的是( )
| A. | S和KNO3都是反应的氧化剂 | B. | C在反应中得电子 | ||
| C. | CO2是反应的氧化产物 | D. | K2S和N2都是反应的还原产物 |
19.通过反应O2+PtF6=O2PtF6可以制得氧所形成的正价盐,经研究表明该化合物(O2PtF6)中存在阴离子PtF6-.下列说法正确的是( )
| A. | 该化合物含有离子键和共价键 | |
| B. | 1molO2参与该反应时,得到1mol电子 | |
| C. | 该化合物中阳离子与阴离子个数比为2:1 | |
| D. | O2PtF6的熔点可能比O2低 |
3.下列实验装置正确且能达到相应实验目的是( )
| A. | 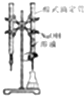 如图装置可用于已知浓度的氢氧化钠溶液滴定未知浓度的盐酸 | |
| B. |  如图装置可用于氯化铵固体和氢氧化钙固体反应制取少量氨气 | |
| C. | 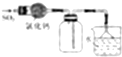 如图装置可用于收集SO2,并吸收多余的SO2 | |
| D. | 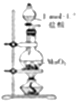 如图装置可用于制取少量Cl2 |
14.下列有关化学反应原理的说法不正确的是( )
| A. | 强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 | |
| B. | 过程的自发性既能用于判断过程的方向,也能用于判断过程发生的速率 | |
| C. | 电解质溶液导电的过程中,一定发生了电解质溶液的电解 | |
| D. | 溶解度较小的BaSO4在一定条件下也可以转化为溶解度略大的BaCO3 |
15.下列说法错误的是( )
| A. | C2H6和C4H10一定是同系物 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 相对分子质量相等的两种物质,不一定是同分异构体 | |
| D. | 烯烃各同系物含碳的质量分数相等 |
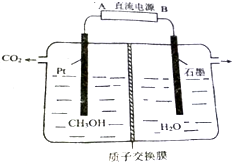 工业废水中的甲醇也可用电化学方法处理,原理如图所示.
工业废水中的甲醇也可用电化学方法处理,原理如图所示.