题目内容
12.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.下列叙述正确的是( )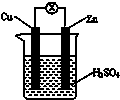
| A. | Zn是负极,发生还原反应 | |
| B. | 一段时间后,铜片质量减轻 | |
| C. | 电流从铜片经导线流向锌片 | |
| D. | 一段时间后,电解质溶液的酸性保持不变 |
分析 原电池是把化学能转变为电能的装置,原电池放电时,较活泼的金属作负极,较不活泼的金属铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极.
解答 解:A、该原电池中,较活泼的金属锌作负极,负极上锌失去电子发生氧化反应,故A错误;
B、原电池放电时,负极上锌失电子生成锌离子进入溶液,质量减轻,正极上氢离子得电子生成氢气,所以铜片质量不变,故B错误;
C、原电池放电时,负极上失去电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,电流从正极沿导线流向负极锌,故C正确;
D、原电池放电时,负极上失去电子发生氧化反应,正极上氢离子得电子生成氢气,消耗氢离子,所以电解质溶液的酸性减弱,故D错误;
故选C.
点评 本题考查了原电池原理,根据原电池的定义、正负极上发生的电极反应、电子的流向和电流的流向分析解答即可,难度不大.

练习册系列答案
相关题目
13.下列各组金属最适宜用H2或CO把它从化合物中还原出来的是( )
| A. | Na、Mg | B. | Al、Fe | C. | Hg、Ag | D. | Fe、Cu |
3.下列有关化学实验的叙述正确的是( )
| A. | 用待测液润洗滴定用的锥形瓶 | |
| B. | 配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 | |
| C. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| D. | Na2CO3溶液保存在带玻璃塞的试剂瓶中 |
20.设NA为阿伏伽德罗常数的值.下列说法正确的是(相对原子量:N-14 H-1)( )
| A. | 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 | |
| B. | 标准状况下,2.24L H2O中含有H2O分子数为0.1NA | |
| C. | 1L 0.1mol/L NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 实验室所制得的1.7g NH3中含有的电子数为NA |
7.已知C(s)+CO2(g)=2CO(g)在常温下为非自发反应(△G>0),下列有关说法正确的是( )
| A. | 该反应是焓减的反应 | |
| B. | 该反应是熵增的反应 | |
| C. | 降低温度可使该反应自发进行 | |
| D. | 无论反应温度是多少,该反应都不能自发进行 |
17.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( )
| A. | CO2 | B. | PCl3 | C. | CCl4 | D. | H2O |
1.“类推”是思维的一种形式,但往往也有不对的,下列“类推”中正确的是( )
| A. | Fe、Cu连接插在稀硫酸中形成的原电池,Fe为负极;那么Fe、Cu连接插在浓硝酸溶液中形成的原电池,Fe也为负极 | |
| B. | HBr的沸点比HCl高,那么HCl的沸点比HF高 | |
| C. | 硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解,那么浓硝酸溶液也要保存在棕色试剂瓶中 | |
| D. | 镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁 |
2. 已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )
已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )
 已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )
已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )| A. | 还原性:Fe2+>I->Br- | |
| B. | 当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| C. | 原混合溶液中FeBr2的物质的量为6mol | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
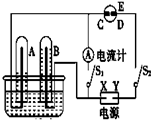 在如图所示的实验装置中,E为一张用淀粉碘化钾溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极.在A、B中充满AgNO3溶液后倒立于盛有AgNO3溶液的水槽中,再分别插入铂电极.切断电源开关S1,闭合开关S2,通直流电一段时间后,B电极质量增重,A极产生无色气体.请回答下列问题:
在如图所示的实验装置中,E为一张用淀粉碘化钾溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极.在A、B中充满AgNO3溶液后倒立于盛有AgNO3溶液的水槽中,再分别插入铂电极.切断电源开关S1,闭合开关S2,通直流电一段时间后,B电极质量增重,A极产生无色气体.请回答下列问题: