题目内容
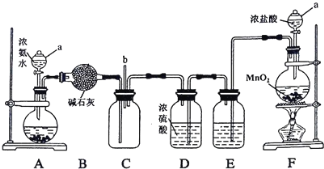
【题目】某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置。
请回答下列问题:
(1)仪器a的名称为_________;装置A的圆底烧瓶中盛放的固体物质可选用__________(填序号)。
a.氯化钠 b.氢氧化钠 c.碳酸钙
(2)装置F的圆底烧瓶中发生反应的离子方程式为___________;装置E的洗气瓶中盛放的试剂为 ____________。
(3)反应过程中,装置C的集气瓶中有大量白烟产生,另一种产物为空气的主要成分之一,该反应的化学方程式为 _________。
(4)从装置C的b处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有 ________溶液的洗气瓶。
【答案】分液漏斗 b MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 饱和氯化钠溶液 8NH3+3Cl2=N2+6NH4Cl 氢氧化钠
Mn2++Cl2↑+2H2O 饱和氯化钠溶液 8NH3+3Cl2=N2+6NH4Cl 氢氧化钠
【解析】
A装置制备氨气,利用B装置中的碱石灰干燥氨气,F装置制备氯气,E装置除去氯气中的氯化氢,D装置干燥氯气,在C装置中氯气氧化氨气,据此解答。
(1)根据仪器构造可判断仪器a的名称为分液漏斗;a.氯化钠与氨水不反应,不能制备氨气;b.氢氧化钠溶于水放热,且增大氢氧根的浓度,可以和氨水混合制备氨气;c.碳酸钙与氨水不反应,不能制备氨气;答案选b;
(2)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。浓盐酸易挥发,生成的氯气中含有氯化氢,E中装有饱和食盐水,食盐水中含有氯离子,能抑制氯气的溶解,作用为除去氯气中混有的氯化氢;
Mn2++Cl2↑+2H2O。浓盐酸易挥发,生成的氯气中含有氯化氢,E中装有饱和食盐水,食盐水中含有氯离子,能抑制氯气的溶解,作用为除去氯气中混有的氯化氢;
(3)C内出现浓厚的白烟为氯化铵,另一生成物是空气的主要成分之一为氮气,因此该反应的方程式为3Cl2+8NH3=N2+6NH4Cl;
(4)氯气是有毒气体,需要尾气处理,则可将尾气通过盛有氢氧化钠溶液的洗气瓶吸收。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
【题目】已知某条件下,合成氨反应的数据如下:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
N2 | H2 | NH3 | |
起始浓度(mol/L) | 1.0 | 3.0 | 0.2 |
2s末浓度(mol/L) | 0.6 | 1.8 | 1.0 |
4s末浓度(mol/L) | 0.4 | 1.2 | 1.4 |
当用氨气浓度的增加来表示该反应的化学反应速率时,下列说法错误的是( )
A. 2~4 s内的平均反应速率为0.2 mol·L-1·s-1
B. 前4 s内的平均反应速率为0.3 mol·L-1·s-1
C. 前2 s内的平均反应速率为0.4 mol·L-1·s-1
D. 2 s末的反应速率为0.4 mol·L-1·s-1