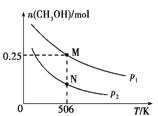
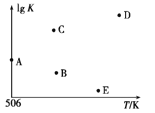
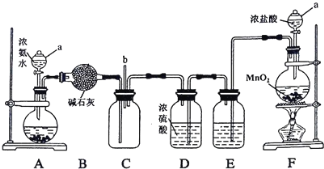
题目内容
【题目】A、B、C、D四种元素,它们原子的核电荷数均小于18,且依次增大,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍。
(1)试推断它们各是什么元素?写出它们的元素符号:
A________,B___________,C__________,D___________。
(2)甲、乙、丙、丁均含有以上元素中的一种或几种组成的10电子微粒;
①甲为分子,且能刻蚀玻璃,则甲的化学式为______
②乙为气体,且遇到无色酚酞溶液变成红色,则乙的化学式为_______
③丙为阳离子,丁为阴离子,且丙和丁在加热条件下生成的两种物质也是10电子微粒,请写出该反应离子方式________。
【答案】H C N O HF NH3 NH4+ + OH- ![]() NH3↑ + H2O
NH3↑ + H2O
【解析】
A原子核内仅有一个质子,推出A为H,D原子有两个电子层,最外层电子数是次外层电子数的3倍,即D为O,B原子的电子总数与D原子的最外层电子数相等,即B为C,A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,即C为N,据此解答。
(1)根据上述分析,A为H,B为C,C为N,D为O;
故答案为:H ;C; N; O;
(2)①甲分子能刻蚀玻璃,工业上常用氢氟酸刻蚀玻璃,因此甲为HF;
②乙为气体,能使无色酚酞溶液变红,说明乙气体溶于水显碱性,即乙为NH3;
③根据10电子微粒,发生的离子反应是NH4++OH-![]() NH3↑+H2O。
NH3↑+H2O。
故答案为:HF;NH3 ;NH4+ + OH- ![]() NH3↑ + H2O。
NH3↑ + H2O。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
【题目】下表是元素周期表的一部分,针对表中的①~⑧中元素,回答以下问题:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在③~⑦元素中,原子半径最大的是__________用元素符号或化学式填空,下同),其离子的原子结构示意图为________。
(2)元素的最高价氧化物对应的水化物中酸性最强的是_____;碱性最强的是______,写出该物质和呈两性的氢氧化物的化学反应方程式____________________;
(span>3)在以上元素的单质中,化学性质最不活泼的是____。