��Ŀ����
����Ŀ��Q��R��X��Y��Z��L����Ԫ�ص�ԭ��������������R��L��ͬ����Ԫ�أ�R�������������ȴ�����������1��L�ĵ��ʳ��³�ѹ�����Ϻ�ɫ���塣Q��X�γɵ����ӻ�����XQ�Ǽ�ʯ�ҵ���Ҫ�ɷ֡�X��Y��Zλ��ͬһ���ڣ�Y����Χ��������������������6����Zλ��ds���Ҳ��ܺ�ϡ���ᷴӦ����H2����ش��������⣺
��1��Q�ļ۲�����Ų�ʽΪ___________________��L�ĺ�����HLO3��L���ӻ���ʽΪ__________�����LO3-�����ӹ���Ϊ________________��
��2��ZR42-��������______����ZSO4��Һ�м������KCN�����������[Z��CN��4]2������1mol��������к��еĦм�����Ŀ��_______����Zͬ���ڵ�Ԫ���У���Zԭ��������������ȵ�Ԫ�ػ���_________����Ԫ�ط��ţ�
��3��Y�������������ͼ��ʾ��������״�ṹ�����������Ļ�ѧʽΪ______________��

��4��X��Z�ľ���ѻ�ģ����ͬ����λ��Ϊ______________����֪Xԭ�Ӱ뾶ԼΪ200pm������X���ܶ�Ϊ__________________g/cm3(������������λ��Ч����)��
��5��XL2���庬�в�״�ṹ���������ǿ���Թ��ۼ�������Է��»��������ӣ���XL2�ľ���������___________��
���𰸡�2s 22p4 sp3 ������ Cl- 4.82��1024 K��Cr CrO3 12 1.5 ����;��������;���
��������
L�ĵ��ʳ��³�ѹ�����Ϻ�ɫ���壬��LΪ�⣻Q��X�γɵ����ӻ�����XQ�Ǽ�ʯ�ҵ���Ҫ�ɷ���Q��R��X��Y��Z��L����Ԫ�ص�ԭ������������������XΪ�ơ�QΪ ����R��L��ͬ����Ԫ�أ�R�������������ȴ�����������1������RΪ�ȣ�X��Y��Zλ��ͬһ���ڣ�Y����Χ��������������������6����Zλ��ds���Ҳ��ܺ�ϡ���ᷴӦ����H2��Y����������Ϊ24,��YΪCrԪ��, ZΪCuԪ����
��1������������֪QΪ��Ԫ�أ��ȵļ۲�����Ų�ʽΪ2s 22p4��L�ĺ�����HIO3�к�����HLO3��HIO3,��ṹΪ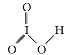 ,����ɵ��ӻ������Ϊ7+4-3
,����ɵ��ӻ������Ϊ7+4-3![]() 2=4,Ϊsp3�ӻ�,���ڳɼ����Ӷ�Ϊ3��,�Һ���һ�Թ¶Ե���,��֪IO3-�Ľṹ����Ϊ������,�𰸣�2s22p4 sp3 ��������
2=4,Ϊsp3�ӻ�,���ڳɼ����Ӷ�Ϊ3��,�Һ���һ�Թ¶Ե���,��֪IO3-�Ľṹ����Ϊ������,�𰸣�2s22p4 sp3 ��������
��2��ZR42-��������Cl-��1��CN�ṹ�к��������м�����1mol[Z��CN��4]2-�к���8mol�м�,����1mol��������к��еĵ���Ŀ��6.02![]() 1023
1023![]() 8=4.82��1024���𰸣�4.82��1024��
8=4.82��1024���𰸣�4.82��1024��
(3)YΪCr,����Cr�Ļ��ϼ��ص��Լ��۲�ṹ��֪����������ԭ��ΪCrԭ��,��Crԭ�Ӽ���һ��Oԭ�ӽ�������,����������Oԭ����������Crԭ��,��һ��Crռ��һ��Oԭ��,��ÿ��Crԭ���ϻ�������û�гɼ���Oԭ��,����ÿ��Crռ��3��Oԭ��,���仯ѧʽΪCrO3;�𰸣�CrO3��
(4)����������֪XΪ�ƣ�ZΪͭ�����ߵľ���ѻ�ģ����ͬ,��Ca��Cu�Ķѻ�ģ����ͬ,��Cu�Ķѻ�ģ��Ϊ�����������ܶѻ���: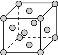 ,��λ��Ϊ12�����ݽṹ��֪һ�������к���4��Caԭ��,����ԭ�Ӱ뾶Ϊ200pm=2��10-8cm,һ������������Caԭ�ӵ�����Ϊ(4��40)/NA,���ΪV=(
,��λ��Ϊ12�����ݽṹ��֪һ�������к���4��Caԭ��,����ԭ�Ӱ뾶Ϊ200pm=2��10-8cm,һ������������Caԭ�ӵ�����Ϊ(4��40)/NA,���ΪV=(![]() r)3,���Լ���ɵ�Ca���ܶ�Ϊ4��40g/6.02��1023(2
r)3,���Լ���ɵ�Ca���ܶ�Ϊ4��40g/6.02��1023(2![]() ��2��10-8cm)3=1.468g/cm2��1.5g/cm3���𰸣�12��1.5��
��2��10-8cm)3=1.468g/cm2��1.5g/cm3���𰸣�12��1.5��
(5)XL2ΪCaCl2,���ھ����к��в�״�ṹ,�Ҳ�����ǿ���Թ��ۼ�,��京�з��»���,���Կ���֪���侧������Ϊ����;��������;��塣�𰸣�����;��������;��塣