题目内容
【题目】铜是人类最早发现并广泛使用的一种金属。回答下列问题:
(1)CuFeS2是其中铜的主要存在形式。CuFeS2中存在的化学键类型是_______。其组成的三种元素中电负性较强的是 _______。
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是____,中心原子杂化类型为____。
②X的沸点比水低的主要原因是___________。
(3)[Cu(NH3)4]2+中,提供孤对电子的是________。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是________(填“极性”或“非极性”)分子,由此推知 [Cu(NH3)4]2+的空间构型是________。
(4)某镍白铜合金的立方晶胞结构如图所示。
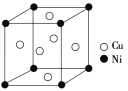
①晶胞中铜原子与镍原子的数量比为________。
②若合金的密度为d g·cm-3,晶胞参数a=________nm。(设NA代表阿伏加德罗常数)
【答案】离子键 硫(S) V形 sp3 水分子间存在氢键 NH3 极性 平面正方形 3∶1 ![]()
【解析】
(1)根据非金属元素和金属元素的性质,判断形成的化学键的类型;非金属性越强,电负性越大;
(2)根据臭鸡蛋气味的气体X产生,则X为H2S,根据H2S的结构特点进行分析;根据氢键的性质解答;
(3) [Cu(NH3)4]2+中的结构特点和相似相溶原理金相分析解答;因为存在两种同分异构体,所以[Cu(NH3)4]2+的空间构型应该是平面正方形;
(4)①由晶胞结构图可知,Ni原子处于立方晶胞的顶点,Cu原子处于立方晶胞的面心,根据均摊法判断每个晶胞中含有Cu原子的个数和Ni原子的个数; 根据m=ρV可得,计算1 mol晶胞的质量,进而求解。
(1)CuFeS2中硫为非金属元素,铁和铜为金属元素之间形成的化学键为离子键;非金属性越强,电负性越大,故S的电负性最大,故答案为:离子键;S;
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生,则X为H2S。
①S原子形成2个S-H键,含有2对孤电子对,杂化轨道数目为4,S原子采取sp3杂化,分子空间构型为V形结构,分子中正负电荷重心不重合,属于极性分子1,故答案为:V形;sp3;极性;
②H2S的沸点比水低的主要原因是:水分子间形成氢键,故答案为:水分子间存在氢键;
(3) [Cu(NH3)4]2+中,铜离子提供空轨道,氨气分子中的氮元素提供孤电子对;Cu(NH3)2Cl2的同分异构体可溶于水,根据相似相溶原理,水是极性分子,所以该分子应该为极性分子;既然存在两种同分异构体,所以[Cu(NH3)4]2+的空间构型应该是平面正方形;故答案为:NH3;极性;平面正方形;
(4)①由晶胞结构图可知,Ni原子处于立方晶胞的顶点,Cu原子处于立方晶胞的面心,根据均摊法,每个晶胞中含有Cu原子的个数为6×![]() =3,含有Ni原子的个数为8×
=3,含有Ni原子的个数为8×![]() =1,故晶胞中Cu原子与Ni原子的数量比为3∶1,故答案为:3∶1;
=1,故晶胞中Cu原子与Ni原子的数量比为3∶1,故答案为:3∶1;
②根据m=ρV可得,1 mol晶胞的质量为(64×3+59)g=a3×d g·cm-3×NA,则a=![]() cm=
cm=![]() nm,故答案为:
nm,故答案为:![]() 。
。

【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。