题目内容
【题目】在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
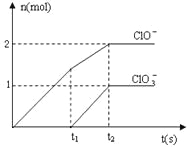
(1)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为:_________________________。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后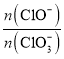 ____2(填“>”、“<”或“=”);
____2(填“>”、“<”或“=”);
若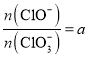 ,则n(C1-)=_________mol(用含a的代数式来表示)。
,则n(C1-)=_________mol(用含a的代数式来表示)。
【答案】10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O 5 < ![]()
【解析】
(1)在t2时,共生成2molClO-和1molClO3-,即氯气一共失去7mol电子,所以应该也有氯气得到7mol电子变为7molCl-,所以可以写出Ca(OH)2与Cl2发生反应的总化学方程式为10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O;
(2)由(1)的反应方程式和图像中的数据,我们可以得到该石灰乳中含有Ca(OH)2的物质的量是5mol;
(3)若在原石灰乳中通入氯气的速度加快,则反应温度升高得较快,根据题意则会生成更多的ClO3-,则反应后 <2;若
<2;若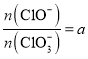 ,即
,即![]() ,假设生成
,假设生成![]() ,则失去了bmol电子,所以生成
,则失去了bmol电子,所以生成![]() ,失去了
,失去了![]() mol电子,故一共失去了
mol电子,故一共失去了![]() mol电子,根据得失电子守恒,反应生成
mol电子,根据得失电子守恒,反应生成![]() mol氯离子,又因为体系中共有5mol钙离子,则n(ClO-)+n(ClO3-)+n(Cl-)=10mol,即b+
mol氯离子,又因为体系中共有5mol钙离子,则n(ClO-)+n(ClO3-)+n(Cl-)=10mol,即b+![]() +
+![]() =10,解得b=
=10,解得b=![]() ,则n(C1-)=
,则n(C1-)= ![]() 。
。