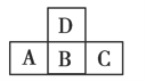题目内容
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2=+23.4kJ/mol
2CH3OH(g) △H2=+23.4kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_______。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子断裂2NA个H-O键,同时氢分子断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正_______v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)%=_______%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=_______;KA、KB、KC三者之间的大小关系为________。

(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%。
×100%。
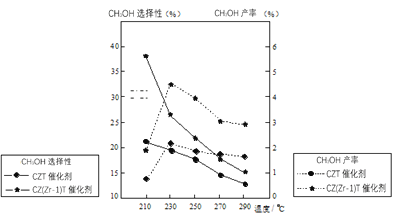
①温度高于230℃,CH3OH产率随温度升高而下降的原因是______。
②在上述条件下合成甲醇的工业条件是_______。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
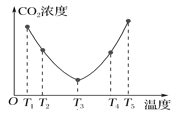
(6)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2 效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图,则ΔH______0(填“>”、“=”或“<”)。
【答案】-122.6kJ/mol AC > 20 0.18mol·L1·min1 KA=KC>KB 反应I的△H<0,温度升高,使CO2转化为CH3OH的平衡转化率下降 BD <
【解析】
(1)根据盖斯定律,△H3=2△H1-△H2= -122.6kJ/mol;
(2)反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
A、该反应是气体体积减小的反应,在恒容条件下,随着反应的进行,体系的总压强减小,所以当体系的总压强不变时,说明反应I达到平衡状态,A正确;
B、反应在恒容条件下进行,且体系的各组分都是气体,则体系的质量和体积始终不变,所以混合气体的密度保持不变,不能说明反应I达到平衡状态,B错误;
C、任何时候都有水分子断裂2NA个H-O键,氢分子生成3NA个H-H键,当氢分子同时生成和断裂3NA个H-H键时,说明反应I达到平衡状态,C正确;
D、反应中,CH3OH和H2O的浓度比始终保持不变,则该选项不能说明反应I达到平衡状态,D错误;
故选AC;
(3)Qc=![]() =
=![]() =0.049<K,则平衡向正反应方向移动,所以v正>v逆;
=0.049<K,则平衡向正反应方向移动,所以v正>v逆;
由于反应向正反应方向移动,设H2O继续转化x mol·L-1,则有
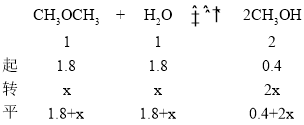
则有:![]() ,解得x=0.2,则CH3OH的体积分数为:
,解得x=0.2,则CH3OH的体积分数为:![]() =20%;
=20%;
(4)反应III为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g),根据题意,投料比n(H2):n(CO2)=12mol:6mol=2,根据图像可知CO2的平衡转化率为60%,即△n(CO2)=6mol×60%=3.6mol,根据方程式可知: △n(CH3OCH3)=1.8mol,则v(CH3OCH3)=
CH3OCH3(g)+3H2O(g),根据题意,投料比n(H2):n(CO2)=12mol:6mol=2,根据图像可知CO2的平衡转化率为60%,即△n(CO2)=6mol×60%=3.6mol,根据方程式可知: △n(CH3OCH3)=1.8mol,则v(CH3OCH3)=![]() = 0.18mol·L-1·min-1;由于A和C的温度相同,且K只和温度有关,所以KA=KC;因为反应III是放热反应,T1→T2,CO2的平衡转化率下降,说明该过程是升温过程,则KA>KB;所以有KA=KC>KB;
= 0.18mol·L-1·min-1;由于A和C的温度相同,且K只和温度有关,所以KA=KC;因为反应III是放热反应,T1→T2,CO2的平衡转化率下降,说明该过程是升温过程,则KA>KB;所以有KA=KC>KB;
(5)反应是放热反应,温度升高,平衡向逆反应方向移动,CO2的转化率下降;从选择性来看,催化剂CZ(Zr-1)T的效果更好,从产率来看,230℃时甲醇的产率更好,故选BD;
(6)观察图像的后半段,随着温度的升高,CO2的浓度增大,是因为溶液中NH4HCO3分解的量越来越多,则该分解反应是吸热反应,所以(NH4)2CO3捕获CO2的反应是放热反应,即ΔH<0。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】已知 A、B、C、D、E 五种元素都是元素周期表中前 20 号元素,原子序数依次增大,E 的外围电子排布式为 4s2。A、B、C、D 四种元素在元素周期表中的相对位置如表所示:
…… | A | ||||||
B | C | D |
根据以上信息,回答下列问题:
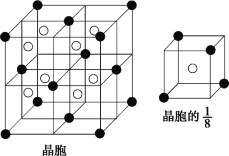
(1) A、D 分别与 B 形成的化合物中,________的晶格能大(填化学式)。
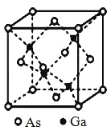
(2)A 和 E 可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。A 和 E 化合物的晶胞 1/8 的体积为 2.0×10-23cm3,求 A 和E 组成的离子化合物的密度为 (结果保留一位小数):________g/cm3。