题目内容
15.A、B、C、D、E代表五种常见元素,它们的核电荷数依次增大.其中元素E的基态3d轨道上有2个电子,A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物.请回答下列问题:(1)E的基态原子价层电子排布式为3d24s2.
(2)AB2分子中,A的杂化类型为sp;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示)N>O>C;1个AB2分子中,含有2个π键和2个δ键.
(3)AB2形成的晶体的熔点低于(填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是CO2形成的晶体属于分子晶体,NaCl属于离子晶体.
(4)E与B形成的一种橙红色晶体晶胞结构如图1所示,其化学式为TiO2(用元素符号表示).ED4是制取航天航空工业材料的重要原料.取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式:TiO2+C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+CO2
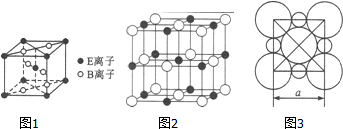
(5)由c、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”. 如图2、3所示为C、D形成化合物的晶胞结构图以及晶胞的剖面图:若a=5.6×10-8cm,则该晶体的密度为2.2g•cm-3.(精确到小数点后1位).
分析 A、B、C、D、E代表五种常见元素,它们的核电荷数依次增大.其中元素E的基态3d轨道上有2个电子,原子核外电子排布为1s22s22p63s23p63d24s2,则E为Ti;B是地壳中含量最多的元素,则B为O元素;C是短周期中最活泼的金属元素,则C为Na;A的基态原子中有2个未成对电子,原子序数小于氧,原子核外电子排布为1s22s22p2,则A为碳元素;D与C可形成CD型离子化合物,则D为Cl,据此解答.
解答 解:A、B、C、D、E代表五种常见元素,它们的核电荷数依次增大.其中元素E的基态3d轨道上有2个电子,原子核外电子排布为1s22s22p63s23p63d24s2,则E为Ti;B是地壳中含量最多的元素,则B为O元素;C是短周期中最活泼的金属元素,则C为Na;A的基态原子中有2个未成对电子,原子序数小于氧,原子核外电子排布为1s22s22p2,则A为碳元素;D与C可形成CD型离子化合物,则D为Cl.
(1)E为Ti,原子核外电子排布为1s22s22p63s23p63d24s2,基态原子价层电子排布式为3d24s2,故答案为:3d24s2;
(2)CO2分子结构式为O=C=O,碳原子成2个δ键、没有孤对电子,故C原子采取sp杂化;同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;1个CO2分子中,含有 2个π键和2个δ键,
故答案为:sp;N>O>C;2;2;
(3)CO2形成的晶体属于分子晶体,NaCl属于离子晶体,通常情况下,离子键键能高于分子间作用力,故CO2形成的晶体的熔点低于NaCl,
故答案为:低于;CO2形成的晶体属于分子晶体,NaCl属于离子晶体;
(4)该晶胞中Ti原子个数=1+8×$\frac{1}{8}$=2、O原子个数=2+4×$\frac{1}{2}$=4,则Ti、O原子个数之比=2:4=1:2,则化学式为TiO2;TiCl4是制取航天航空工业材料的重要原料.取上述橙红色晶体,放在电炉中,通入Cl2和碳的单质后高温加热,可制得TiCl4,同时产生一种造成温室效应的气体,该气体为二氧化碳,该反应的化学方程式为:TiO2+C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+CO2,
故答案为:TiO2;TiO2+C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+CO2;
(5)由Na、Cl两元素形成的化合物为NaCl,以中间的黑色球为Na+离子研究,与之最近的Na+离子处于晶胞的棱上,共有12个.晶胞中Na+离子数目=1+12×$\frac{1}{4}$=4,Cl-离子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量=$\frac{4×58.5}{6.02×1{0}^{23}}$g,晶胞体积=(5.6×10-8cm)3,则该晶体的密度为$\frac{4×58.5}{6.02×1{0}^{23}}$g÷(5.6×10-8cm)3=2.2 g•cm-3,
故答案为:2.2.
点评 本题是对物质结构的考查,涉及晶胞计算、杂化轨道、电离能、核外电子排布、晶体性质等,推断元素是解题关键,注意利用均摊法进行晶胞计算.

 名校课堂系列答案
名校课堂系列答案| A. | CO2 | B. | CaCl2 | C. | NH4Cl | D. | NaOH |
| A. | X与Y形成的化合物只有一种 | |
| B. | 原子半径的大小顺序:r(R)>r(W)>r(Y) | |
| C. | 元素R的简单气态氢化物的热稳定性比W的强 | |
| D. | Y的最高价氧化物对应水化物的酸性比W的强 |
| A. | 测量Cu与浓硝酸反应产生气体的体积: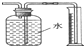 | |
| B. | 验证Na和水反应为放热反应: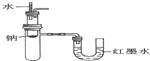 | |
| C. | 制取干燥的氨气: | |
| D. | 收集H2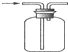 |
| A. | CO2的比例模型: | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | 乙烯的结构简式为:CH2CH2 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
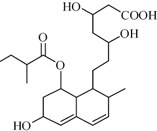 M是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于M的性质描述不正确的是( )
M是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于M的性质描述不正确的是( )| A. | M不能与FeCl3溶液发生显色反应 | |
| B. | 0.1mol M足量的Na反应可产生4.48LH2 | |
| C. | M能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与2molNaOH反应 |
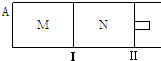
| A. | 若x=2,达到平衡后B 的体积分数关系为:φ(M)>φ(N) | |
| B. | 若x<2,达到平衡后B的转化率关系为:α(M)>α(N) | |
| C. | 若x>2,C的平衡物质的量浓度关系为:c(M)>c(N) | |
| D. | x不论为何值,起始时向N容器中充入任意值的A,平衡后N容器中B的浓度均相等 |