题目内容
20.下列化学用语正确的是( )| A. | CO2的比例模型: | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | 乙烯的结构简式为:CH2CH2 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
分析 A.二氧化碳分子中存在两个碳氧双键,为直线型结构,碳原子的相对体积大于氧原子;
B.次氯酸的中心原子为O原子,不存在氢氯键;
C.乙烯的结构简式中没有标出碳碳双键;
D.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.二氧化碳分子中,碳原子的相对体积大于氧原子,其正确的比例模型为: ,故A错误;
,故A错误;
B.次氯酸分子中存在1个氧氢键和1个氧氯键,次氯酸正确的结构式为:H-O-Cl,故B错误;
C.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故C错误;
D.原子核内有10个中子的氧原子的质量数为18,该元素符号可以表示为:${\;}_{8}^{18}$O,故D正确;
故选D.
点评 本题考查了常见化学用语表示方法,题目难度中等,注意掌握比例模型、结构式、结构简式、元素符号等化学用语的概念及表示方法,明确比例模型与球棍模型、结构式与结构简式的区别,试题培养了学生规范答题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.将下列固体投入适量水中,再滴加酚酞,溶液不会变为红色的是( )
| A. | Na | B. | Na2O | C. | Na2CO3 | D. | NaCl |
8.下列离子方程式书写正确的是( )
| A. | 小苏打溶液呈碱性的原因:HCO3-+H2O?H3O++CO32- | |
| B. | 向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| D. | 少量A1Cl3溶液滴入过量氨水中:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
5.下列叙述正确的是( )
| A. | 制备乙酸乙酯时可用热的NaOH代替饱和NaHCO3溶液来除去其中的乙酸 | |
| B. | SO2使酸性KMnO4溶液褪色与乙烯使溴水褪色的原理相同 | |
| C. | 可用CuSO4溶液除去制乙炔时混有的杂质H2S | |
| D. | 在AgI饱和溶液中加入KCl固体可产生白色沉淀,说明Ksp(AgCl)<Ksp(AgI) |
12.化学与生产生活、环境保护、资源利用息息相关.下列叙述错误的是( )
| A. | 火力发电厂的燃煤中加适量石灰石,有利于环境保护 | |
| B. | 硅胶可做装食品的干燥剂 | |
| C. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 | |
| D. | 利用农作物秸秆制取乙醇 |
10.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,2.24L苯含有的分子数为0.1nA | |
| B. | 25℃时,PH=13的Ba(OH)2的溶液中含有OH-的数目为0.2nA | |
| C. | 1L0.1mol•L-1Al2(SO4 )3的溶液Al3+的数目为0.2nA | |
| D. | 1.5molNO2与足量H2O反应,转移的电子数为nA |
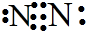 和结构式N≡N.
和结构式N≡N.