题目内容
12.A、B、C、D、E是同周期元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中原子半径最大的,则它们的原子序数由小到大的顺序为( )| A. | E、B、A、D、C | B. | D、B、C、A、E | C. | E、C、D、B、A | D. | A、B、C、D、E |
分析 同周期元素从左到右,元素的金属性减弱、非金属性增强,金属性越强,最高价氧化物的水化物的碱性越强,非金属性越强,最高价氧化物的水化物的酸性越强,据此判断A、B、C、D的原子序数大小,E是这五种元素中原子半径最大的,同周期元素从左到右,原子半径在逐渐减小,故E的原子序数最小,据此进行解答.
解答 解:由于A、B、C、D四种同周期元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A,则金属性B>A,C、D的最高价氧化物水化物是酸,且C比D的酸性强,则非金属性C>D,由同周期元素从左到右,元素的金属性减弱,非金属性增强,则A、B、C、D的原子序数由小到大的顺序为B<A<D<C,E是这五种元素中原子半径最大的,同周期元素从左到右,原子半径在逐渐减小,故E的原子序数最小,所以五种元素的原子序数由小到大的顺序为E<B<A<D<C,故选:A.
点评 本题考查位置结构性质的关系,难度不大,明确同周期元素性质的变化规律是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列溶液中Cl-浓度最大的是( )
| A. | 10ml 0.2mol/L的FeCl3溶液 | B. | 10ml 0.1mol/L的AlCl3溶液 | ||
| C. | 20ml 0.1mol/L的溶MgCl2液 | D. | 20ml 0.1mol/L的HCl溶液 |
3.100mL浓度为2mol•L-1的硫酸跟足量的锌片反应,为增大反应速率,又不影响生产氢气的总量,可采取的方法是( )
| A. | 加入适量的5mol•L-1的硫酸 | B. | 加入少量醋酸钠固体 | ||
| C. | 加热 | D. | 加入少量金属钠 |
20.下列各组物质中,互为同分异构体的是( )
| A. | CH3CH2OH 和CH3OCH3 | B. | 淀粉和纤维素 | ||
| C. | 金刚石和石墨 | D. | CH3CH2CH3和CH3CH2CH2CH3 |
7.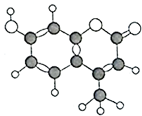 某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )
某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )
①分子式为C10H9O3
②该分子中10个碳原子都可能在同一平面上
③1mol该物质最多能与5molH2加成
④该物质能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3molNaOH的溶液反应
⑥1mol该物质与足量浓溴水反应,最多消耗3molBr2
⑦该物质遇FeCl2溶液不变色
⑧该物质能和Na2CO3溶液、NaHCO3溶液反应.
 某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )
某种有机物由C、H、O三种元素组成,其分子球棍模型如图所示,下列有关叙述正确的是( )①分子式为C10H9O3
②该分子中10个碳原子都可能在同一平面上
③1mol该物质最多能与5molH2加成
④该物质能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3molNaOH的溶液反应
⑥1mol该物质与足量浓溴水反应,最多消耗3molBr2
⑦该物质遇FeCl2溶液不变色
⑧该物质能和Na2CO3溶液、NaHCO3溶液反应.
| A. | ①②④⑥ | B. | ②③⑤⑥ | C. | ②④⑦⑧ | D. | ②④⑤⑥ |
17.下列说法正确的是( )
| A. | Cl-的半径比Cl的半径小 | |
| B. | Cl2和Cl-都有毒性 | |
| C. | Cl-和Cl2都呈黄绿色 | |
| D. | Cl、HClO、Cl2及Cl-中,Cl的化学活动性最强 |
4.在A+B(s)?C的反应中,若增大压强或降低温度,B的转化率均增大,则反应体系应是( )
| A. | A是固体,C是气体,正反应吸热 | B. | A是气体,C是液体,正反应放热 | ||
| C. | A是气体,C是气体,正反应放热 | D. | A是气体,C是气体,正反应吸热 |
9.下列化学用语正确的是( )
| A. | S原子的结构示意图: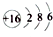 | B. | 氯化氢的电子式: | ||
| C. | 乙烯的结构式:CH2CH2 | D. | CH4分子的比例模型: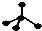 |