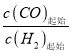题目内容
【题目】【全国省级联考.东北三省四市教研联合体2017届高三高考模拟试题(一)】下列说法正确的是
A. KAl(SO4)2溶液中 c(K+)= 2c(SO42-)
B. 向NaHCO3溶液中加入少量 Ba(OH)2固体,c(CO32-)增大
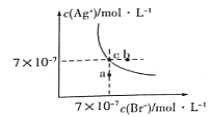
C. 含有AgCl和AgBr固体的悬浊液中,C(Ag+)>c(Cl-) =c(Br-)
D. 常温下,向含0.1molCH3COOH的溶液中加入amolNaOH固体,反应后溶液中c(CH3COOH) =c(CH3COO-),则溶液显碱性。(已知醋酸Ka =1.75×10-5 )
【答案】B
【解析】A 项, 根据电荷守恒KAl(SO4)2溶液中 c(K+)+3c(Al3+)= 2c(SO42-),故A项错误;B项,向NaHCO3溶液中加入少量 Ba(OH)2固体,反应离子方程式为2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-,所以c(CO32-)增大,故B项正确;C项,悬浊液中AgCl和AgBr均达到沉淀溶解平衡,Ksp(AgCl)=C(Ag+)c(Cl-),Ksp(AgBr) =C(Ag+)c(Br-),因为Ksp(AgCl)≠Ksp(AgBr) ,所以c(Cl-)≠c(Br-),故C项错误;D项,c(CH3COOH) =c(CH3COO-),常温下根据电离常数 Ka=1.75×10-5和Ka=![]() 可得:c(H+)=Ka=1.75×10-5>10-7,所以溶液显酸性,故D项错误。综上所述,符合题意的选项为B。
可得:c(H+)=Ka=1.75×10-5>10-7,所以溶液显酸性,故D项错误。综上所述,符合题意的选项为B。
【名师点评】:本题考查电解质溶液,涉及电荷守恒、与量有关的反应、沉淀溶解平衡和电离常数等知识,题目难度一般。注意与量有关的反应常用定“1”法分析,如NaHCO3和少量 Ba(OH)2反应,把 Ba(OH)2前面化学计量数暂定为“1”,则1molBa(OH)2要消耗2molNaHCO3生成1molBaCO3、2molH2O和1molNa2CO3。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案