题目内容
【题目】甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物。有关反应的热化学方程式如下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)= H2O(l)△H=-44kJ/mol
I.写出CH3OH(l)不完全燃烧生成CO和H2O(l)的热化学方程式:_________________。
II. 工业上可用CO和H2制取甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ/mol。为研究该反应平衡时CO转化率与反应物投料比(反应物投料比=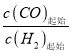 )以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
)以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
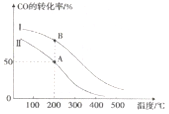
回答下列问题:
(1)反应热a____0(填“>”或“<”),判断理由是______。
(2)在其他条件相同,曲线I、II分别表示反应物投料比不同时的反应过程曲线。
①反应物投料比I_____II(填“>”或“<” 或“=”)。
②若按曲线II反应,n(CO)起始=10mol,反应物投料比=0.5,则A点的平衡常数(Ka)值为____,B点的平衡常数(Kb)值为________________。
(3)为提高CO的转化率,除了可以适当改变反应物与生成物的浓度外,还可以采取的措施有:________________、_______________。
【答案】 CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJ/mol < 升高温度,CO的转化率降低,平衡左移,所以正反应为放热反应。a<0 < 1 1 降低温度 增大压强
【解析】试题分析:I.根据盖斯定律计算CH3OH(l)不完全燃烧生成CO和H2O(l)的焓变; II. (1).升高温度,转化率降低,平衡逆向移动;相同温度下,增大氢气浓度,平衡正向移动,CO的转化率增大。降低温度或 增大压强都能使平衡正向移动。
解析:I.根据盖斯定律,①÷2-②÷2+③×2得CH3OH(l)不完全燃烧生成CO和H2O(l)的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJ/mol;II.(1)升高温度,转化率降低,平衡左移,所以正反应为放热反应,反应热a<0;(2)在其他条件相同,曲线I、II分别表示反应物投料比不同时的反应过程曲线。
①增大氢气浓度,平衡正向移动,CO的转化率增大,所以 反应物投料比I<II;
反应物投料比I<II;
②

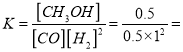 1
1
A、B两点的温度相同,相同温度下平衡常数相同,故B点的平衡常数为1;
(3)为提高CO的转化率,可以让平衡正向移动,采取的措施有:降低温度、增大压强。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案