题目内容
【题目】卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,xx,型卤素互化物与卤素单质结构相似,性质相近.试回答下列问题:
(1)写出ICl的电子式 ,写出该物质与NaOH溶液反应的化学方程式
(2)卤素互化物BrCl能发生下列反应:KBr+BrCl=KCl+Br2,写出KI与IBr反应的化学方程式
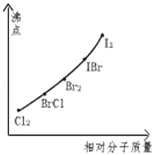
(3)下图是部分卤素单质和xx,型卤素互化物的沸点与其相对分子质量的关系图.它们的沸点随着相对分子质量的增大而升高,其原因是 .
(4)试推测ICl的沸点所处于的最小范围 .
【答案】(1)![]() ; 2NaOH+ICl═NaCl+NaIO+H2O;
; 2NaOH+ICl═NaCl+NaIO+H2O;
(2)
KI+IBr═KBr+I2;
(3)
分子晶体的熔沸点随分子量的增大而升高;
(4)Br2<ICl<IBr.
【解析】
试题分析:(1)氯化碘结构和氯气相似,Cl原子和I原子之间共用一对电子,ICl和卤素单质结构相似,性质相近,依据氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水写出化学方程式;
(2)KI与IBr反应生成溴化钾和碘;
(3)根据分子晶体熔沸点与其相对分子质量的关系解答;
(4)分子晶体的熔沸点随分子量的增大而升高.
解:(1)氯化碘结构和氯气相似,Cl原子和I原子之间共用一对电子,所以氯化碘的电子式为![]() ,ICl和卤素单质结构相似,性质相近,依据氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水写出化学方程式为:2NaOH+ICl═NaCl+NaIO+H2O,
,ICl和卤素单质结构相似,性质相近,依据氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水写出化学方程式为:2NaOH+ICl═NaCl+NaIO+H2O,
故答案为:![]() ; 2NaOH+ICl═NaCl+NaIO+H2O;
; 2NaOH+ICl═NaCl+NaIO+H2O;
(2)KI与IBr反应生成溴化钾和碘,反应方程式为KI+IBr=KBr+I2,
故答案为:KI+IBr═KBr+I2;
(3)分子晶体的熔沸点与其相对分子质量成正比,相对分子质量越大其熔沸点越高,
故答案为:分子晶体的熔沸点随分子量的增大而升高;
(4)分子晶体的熔沸点随分子量的增大而升高,这三种物质都是分子晶体,其相对分子质量越大,该物质的熔沸点越高,所以ICl的沸点所处的最小范围:Br2<ICl<IBr,故答案为:Br2<ICl<IBr.

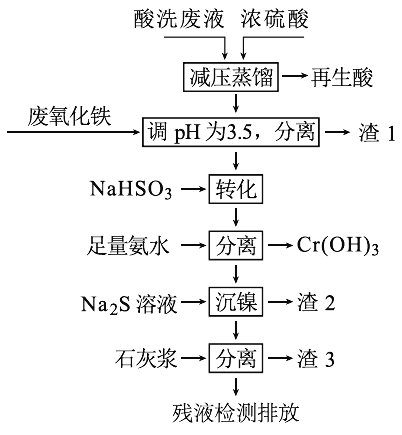
【题目】用HNO3和HF的混酸处理某金属后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等。下图是综合利用该酸洗废液的工艺流程:
已知:
金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取减压蒸馏的目的为____________,
(2)滤渣1的主要成份为:____________。
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:________。
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:____________。
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和_____。
(6)经检测,最后的残液中c(Ca2+)=0.001 molL-1,则残液中F-浓度为____mgL-1,______(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL-1]。