题目内容
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行处理可实现绿色环保、废物利用。
Ⅰ.CO可用于合成甲醇
(1)已知CO、H2、CH3OH(g)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-764.5kJ/mol,则CO(g)+2H2(g)![]() CH3OH(g)的△H=________。
CH3OH(g)的△H=________。
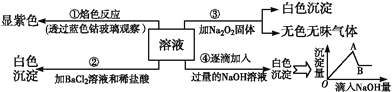
(2)将lmolCO和2molH2充入密闭容器中发生上述反应。其他条件相同时.CO的平衡转化率与压强(P)和温度(T)的关系如图所示。

① A、B两点CH3OH的质量分数ω(A)_____ω(B )(填“>”、“<”或“=”)。
② C、D两点的逆反应速率:v(C)_____v(D)(同上)。
③ 200℃ 时,测得E点的容器容积为10L。该温度下,反应的平街常数K=_______;保持温度和容积不变,再向容器中充入lmolCO、lmolH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为________。
Ⅱ. CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景。T℃时,在容积为lL的恒容密闭容器中,充入lmolCO2和3molH2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,达到平衡状态,其它条件不变,下列措施中能使
CH3OH(g)+H2O(g) △H<0,达到平衡状态,其它条件不变,下列措施中能使![]() 增大的是______(填选项字母)。
增大的是______(填选项字母)。
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g)
C.加入催化剂 D.再充入一定量H2O
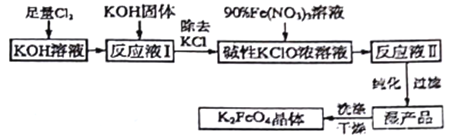
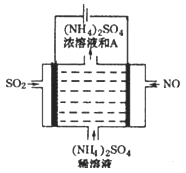
Ⅲ.(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_____,阴极的电极反应式是_____________。
【答案】 -90.1 kJmol-1 > > 2500 0≤x<58 B H2SO4 NO+6H++5e-=NH4++H2O
【解析】试题分析:本题考查盖斯定律的应用,化学平衡图像的分析,化学平衡常数的计算和应用,外界条件对化学平衡的影响,电解原理的应用。
I.(1)根据CO、H2、CH3OH(g)的燃烧热可写出三个热化学方程式:
CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0kJ/mol(①式)
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol(②式)
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ/mol(③式)
应用盖斯定律,将①式+②式![]() 2-③式得CO(g)+2H2(g)
2-③式得CO(g)+2H2(g)![]() CH3OH(g)的△H=(-283.0kJ/mol)+(-285.8kJ/mol)
CH3OH(g)的△H=(-283.0kJ/mol)+(-285.8kJ/mol)![]() 2-(-764.5kJ/mol)=-90.1kJ/mol。
2-(-764.5kJ/mol)=-90.1kJ/mol。
(2)①A、B两点压强相同,温度A低于B,升高温度平衡向逆反应方向移动,CH3OH的质量分数减小,则ω(A)![]() ω(B)。
ω(B)。
②C、D两点温度相同,压强C大于D,对有气体参加的反应,其他条件不变时,压强越大反应速率越快,则C、D两点的逆反应速率υ(C)![]() υ(D)。
υ(D)。
③由图知E点CO的转化率为80%,用三段式
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
n(起始)(mol) 1 2 0
n(转化)(mol) 0.8 1.6 0.8
n(平衡)(mol) 0.2 0.4 0.8
E点的容器容积为10L,平衡时CO、H2、CH3OH(g)的浓度依次为0.02mol/L、0.04mol/L、0.08mol/L,反应的平衡常数K=c[CH3OH(g)]/[c(CO)·c2(H2)]= ![]() =2500。保持温度和容积不变,再向容器中充入lmolCO、lmolH2和xmolCH3OH时,若使υ正>υ逆,即浓度商小于K,
=2500。保持温度和容积不变,再向容器中充入lmolCO、lmolH2和xmolCH3OH时,若使υ正>υ逆,即浓度商小于K, ![]() 2500,解得x
2500,解得x![]() 58,x取值范围为0
58,x取值范围为0![]() x
x![]() 58。
58。
II.(3)A项,升高温度,平衡向逆反应方向移动, ![]() 减小;B项,再充入1molCH3OH(g)和1molH2O(g)用一边倒极限换算后等效于再充入1molCO2和3molH2,相当于增大压强,平衡向正反应方向移动,
减小;B项,再充入1molCH3OH(g)和1molH2O(g)用一边倒极限换算后等效于再充入1molCO2和3molH2,相当于增大压强,平衡向正反应方向移动, ![]() 增大;C项,加入催化剂,化学平衡不发生移动,
增大;C项,加入催化剂,化学平衡不发生移动, ![]() 不变;D项,再充入一定量的H2O,平衡向逆反应方向移动,
不变;D项,再充入一定量的H2O,平衡向逆反应方向移动, ![]() 减小;答案选B。
减小;答案选B。
III.(4)雾霾中的NO、SO2分别转化为NH4+和SO42-,反应的方程式为NO+SO2![]() NH4++SO42-,N的化合价由+2价降至-3价,S的化合价由+4价升至+6价,根据化合价升降总数相等配平为2NO+5SO2
NH4++SO42-,N的化合价由+2价降至-3价,S的化合价由+4价升至+6价,根据化合价升降总数相等配平为2NO+5SO2![]() 2NH4++5SO42-,结合原子守恒和电荷守恒得2NO+5SO2+8H2O
2NH4++5SO42-,结合原子守恒和电荷守恒得2NO+5SO2+8H2O![]() 2NH4++5SO42-+8H+,物质A的化学式为H2SO4。由装置图知,NO通入阴极上,阴极电极反应式为NO+6H++5e-=NH4++H2O。
2NH4++5SO42-+8H+,物质A的化学式为H2SO4。由装置图知,NO通入阴极上,阴极电极反应式为NO+6H++5e-=NH4++H2O。

【题目】控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 2.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 2.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 2.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明:在其它条件相同时,对反应速率有影响.
(2)我们最好选取实验(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的 , 反应速率越快.
(3)利用表中数据,可以求得:硫酸的物质的量浓度是mol/L.