题目内容
【题目】控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 2.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 2.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 2.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明:在其它条件相同时,对反应速率有影响.
(2)我们最好选取实验(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的 , 反应速率越快.
(3)利用表中数据,可以求得:硫酸的物质的量浓度是mol/L.
【答案】
(1)温度
(2)1、2、4;接触面积越大
(3)2
【解析】解:(1)实验2和实验3中,除了温度不同外,其它条件完全相同,则说明探究的是温度对反应速率的影响,温度越高,反应速率越快,所以答案是:温度;(2)根据表中数据可知,实验1、2和4中,除了锌的形状不同外,其它条件完全相同,则它们是探究锌的形状对反应速率的影响;固体的接触面积越大,反应速率越快,所以答案是:1、2、4;接触面积越大;(3)根据实验6和实验7可知,加入等量的锌生成的硫酸锌质量相同,说明两个实验中硫酸完全反应,16.1g硫酸锌的物质的量为: ![]() =0.1mol,则原硫酸溶液的物质的量浓度为:
=0.1mol,则原硫酸溶液的物质的量浓度为: ![]() =2mol/L,所以答案是:2.
=2mol/L,所以答案是:2.

【题目】用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( ) 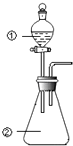
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀硫酸 | 硝酸亚铁溶液 | 无明显现象 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生大量白色沉淀 |
D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.A
B.B
C.C
D.D