题目内容
【题目】I.高铁酸钾(K2FeO4)具有很强的氧化性,在生产,生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____。
(2)制备K2FeO4可以采用湿式氧化法,流程如图:
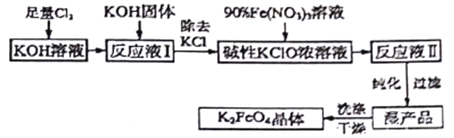
己知:① 温度较低时,Cl2通入KOH溶液生成次氯酸盐;温度较高时,Cl2通入KOH溶液生成氯酸盐;② Fe(NO3)3溶液与KClO溶液在强碱性环境中生成K2FeO4。请回答下列问题:
① 该生产工艺应在_____(填“温度较高”或“温度较低”)的情况下进行。
② 写出产生K2FeO4的离子方程式_________。
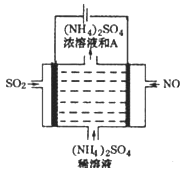
(3)实验室模拟工业电解法制取K2FeO4,装置如图.

①此装置中电源的负极是______(填“a”或“b”).
②阳极的电极反应式为______.
II.常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因_____________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)_____(填“>”、“<”或“=”)0.1mol/LNaOH溶液中由水电离出的c(H+)。
【答案】 FeO42-具有强氧化性,可以消毒,FeO42-被还原成Fe3+,水解生成氢氧化铁胶体吸附悬浮物,可以净水 较低温度 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O a Fe-6e-+8OH-=FeO42-+4H2O A-+H2O![]() HA+OH- >
HA+OH- >
【解析】试题分析:本题以制备K2FeO4的流程为载体,考查流程的分析,实验条件的选择,电解原理的应用,盐类水解离子方程式的书写,外界条件对水的电离平衡的影响。
I.(1)K2FeO4常用做高效水处理剂,其两种作用是:FeO42-具有强氧化性,可以消毒;FeO42-被还原成Fe3+,Fe3+水解生成氢氧化铁胶体吸附悬浮物,可以净水。
(2)①根据题意,温度较低时,Cl2通入KOH溶液生成次氯酸盐;温度较高时,Cl2通入KOH溶液生成氯酸盐。流程中Fe(NO3)3溶液与KClO溶液在强碱性环境中生成K2FeO4,所以要减少氯酸盐的生成,该生产工艺应在温度较低的情况下进行。
②由流程知碱性KClO浓溶液将Fe(NO3)3氧化生成K2FeO4,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O。
(3)根据装置图和目的,在电解装置中Fe被氧化成FeO42-,所以铁棒为阳极,石墨棒为阴极。①石墨棒与a相连,电源的负极为a。
②在碱性条件下阳极的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O。
II.(1)0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合,两者恰好完全反应生成NaA,测得混合溶液的pH=8,说明NaA为强碱弱酸盐,A-发生水解,水解的离子方程式为A-+H2O![]() HA+OH-。
HA+OH-。
(2)混合溶液中由于A-发生水解,促进水的电离;NaOH溶液中NaOH电离出OH-,抑制水的电离,所以混合溶液中由水电离出的c(H+)![]() 0.1mol/LNaOH溶液中由水电离出的c(H+)。
0.1mol/LNaOH溶液中由水电离出的c(H+)。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案