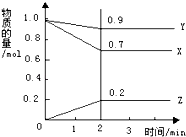
题目内容
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:
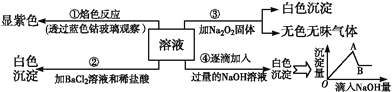
请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
【答案】 SO42- 酸 2Na2O2+2H2O=4NaOH+O2↑ Al(OH)3、Mg(OH)2 Al(OH)3+OH-=AlO2-+2H2O
【解析】溶液透过蓝色钴玻璃焰色反应呈紫色,说明溶液中含有K+离子,溶液呈无色,则一定不含Fe3+、Fe2+、Cu2+,逐滴加入过量NaOH溶液有白色沉淀,则溶液中含有Mg2+离子,一定不含CO32-,加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子,第③个实验中,生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子,一定不含有铵根离子,综上可知:原溶液中一定含有Al3+、Mg2+、K+、SO42-,一定不含Fe3+、Fe2+、NH4+、Cu2+、CO32-;
(1)原溶液中一定存在的阴离子有SO42-,是强酸弱碱盐溶液,原溶液可能呈酸性;
(2)实验③中产生无色无味气体是过氧化钠与水反应,化学方程式为:2Na2O2+2H2O═4NaOH+O2↑;
(3)由于溶液中含Al3+、Mg2+、K+、SO42-,故加入氢氧化钠溶液后,产生的沉淀有:Al(OH)3、Mg(OH)2;
(4)由A→B过程是氢氧化钠溶液过量,生成的Al(OH)3沉淀溶于过量的氢氧化钠溶液,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O。

【题目】用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( ) 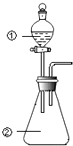
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀硫酸 | 硝酸亚铁溶液 | 无明显现象 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生大量白色沉淀 |
D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.A
B.B
C.C
D.D