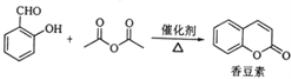
题目内容
【题目】下列实验装置中,设计合理的是
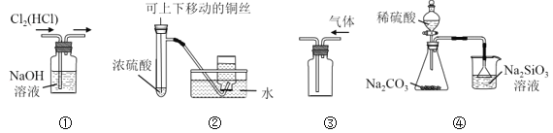
A. 图①用于除去Cl2中混有的HCl气体
B. 图②用于制取并收集少量SO2气体
C. 图③用于排空气法收集CO2气体
D. 图④比较硫、碳、硅三种元素的非金属性强弱
【答案】D
【解析】
A.二者均与NaOH溶液反应,不能除杂,应选饱和食盐水、洗气,故A错误;B.常温下,Cu与浓硫酸无明显现象,且二氧化硫能与水反应,在水中的溶解度较大,不能用排水法收集二氧化硫,故B错误;C.CO2气体的密度比空气密度大,则应长导管进气,故C错误;D.硫酸与碳酸钠反应生成二氧化碳,二氧化碳与硅酸钠反应生成硅酸沉淀,根据现象比较最高价含氧酸的酸性,以此可比较硫、碳、硅三种元素的非金属性强弱,故D正确;故选D。

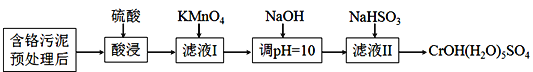
【题目】某含铬污泥主要含Cr2O3、Al2O3、Fe2O3等物质,该污泥可以用湿法回收利用,流程如下图所示:
已知:室温下部分氢氧化物的Ksp见下表
Al(OH)3 | Fe(OH)3 | Cr(OH)3 | Mn(OH)2 | |
Ksp | 3×10-34 | 4×10-38 | 6×10-31 | 4×10-14 |
(1)酸浸前,对含铬污泥进行预处理即加水湿磨成浆体,湿磨的作用是_____________。
(2)向滤液I加KMnO4氧化Cr3+的离子方程式是________________________________;将Cr3+氧化的目的是____________________________________________________。
(3)室温下,调pH=10时, ![]() =_____;调溶液pH不能大于10,理由是_________。
=_____;调溶液pH不能大于10,理由是_________。
(4)NaHSO3在反应中的作用是___________;理论上n(NaHSO3):n[CrOH(H2O)5SO4]之比是_______________。
(5)NaHSO3固体在空气中易变质,写出检验NaHSO3是否变质的方法______________。