题目内容
【题目】某含铬污泥主要含Cr2O3、Al2O3、Fe2O3等物质,该污泥可以用湿法回收利用,流程如下图所示:
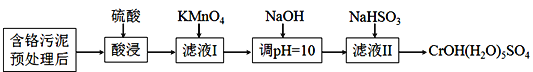
已知:室温下部分氢氧化物的Ksp见下表
Al(OH)3 | Fe(OH)3 | Cr(OH)3 | Mn(OH)2 | |
Ksp | 3×10-34 | 4×10-38 | 6×10-31 | 4×10-14 |
(1)酸浸前,对含铬污泥进行预处理即加水湿磨成浆体,湿磨的作用是_____________。
(2)向滤液I加KMnO4氧化Cr3+的离子方程式是________________________________;将Cr3+氧化的目的是____________________________________________________。
(3)室温下,调pH=10时, ![]() =_____;调溶液pH不能大于10,理由是_________。
=_____;调溶液pH不能大于10,理由是_________。
(4)NaHSO3在反应中的作用是___________;理论上n(NaHSO3):n[CrOH(H2O)5SO4]之比是_______________。
(5)NaHSO3固体在空气中易变质,写出检验NaHSO3是否变质的方法______________。
【答案】 增大接触面积,加快反应速率,增加酸浸时金属元素浸出率 10 Cr3+ + 6MnO![]() + 11H2O=6Mn2+ + 5Cr2O
+ 11H2O=6Mn2+ + 5Cr2O![]() + 22H+ 防止调pH=10时,Cr3+生成Cr(OH)3沉淀使铬回收率下降 7.5×103 防止碱性过强Al(OH)3沉淀溶解生成AlO
+ 22H+ 防止调pH=10时,Cr3+生成Cr(OH)3沉淀使铬回收率下降 7.5×103 防止碱性过强Al(OH)3沉淀溶解生成AlO![]() ,无法分离 还原剂 3:2 取少量NaHSO3固体加适量水溶解,先加稀盐酸再加BaCl2溶液,若有白色沉淀生成,则NaHSO3已变质;若无白色沉淀则未变质
,无法分离 还原剂 3:2 取少量NaHSO3固体加适量水溶解,先加稀盐酸再加BaCl2溶液,若有白色沉淀生成,则NaHSO3已变质;若无白色沉淀则未变质
【解析】(1)酸浸前,对含铬污泥进行预处理即加水湿磨成浆体,湿磨可以增大接触面积,加快反应速率,增加酸浸时金属元素浸出率,故答案为:增大接触面积,加快反应速率,增加酸浸时金属元素浸出率;
(2)KMnO4氧化Cr3+的离子方程式为10 Cr3+ + 6 MnO4-+ 11H2O=6Mn2+ + 5Cr2O72- + 22H+;根据氢氧化物的Ksp,将Cr3+氧化可以防止调pH=10时,Cr3+生成Cr(OH)3沉淀使铬回收率下降,故答案为:10 Cr3+ + 6 MnO4-+ 11H2O=6Mn2+ + 5Cr2O72- + 22H+;防止调pH=10时,Cr3+生成Cr(OH)3沉淀使铬回收率下降;
(3)室温下,调pH=10时, ![]() =
=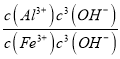 =
=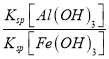 =
=![]() =7.5×103;为了防止碱性过强Al(OH)3沉淀溶解生成AlO2-,无法分离,溶液pH不能大于10,故答案为:7.5×103;防止碱性过强Al(OH)3沉淀溶解生成AlO2-,无法分离;
=7.5×103;为了防止碱性过强Al(OH)3沉淀溶解生成AlO2-,无法分离,溶液pH不能大于10,故答案为:7.5×103;防止碱性过强Al(OH)3沉淀溶解生成AlO2-,无法分离;
(4)加入NaHSO3可以将溶液的Cr2O72-还原为Cr3+;根据得失电子守恒,理论上n(NaHSO3)×(6-4)=n[CrOH(H2O)5SO4]×(6-3),解得n(NaHSO3):n[CrOH(H2O)5SO4]=3:2,故答案为:还原剂;3:2;
(5)NaHSO3固体在空气中易被空气氧化为硫酸氢钠而变质,检验NaHSO3是否变质只需要检验硫酸根离子即可,方法为取少量NaHSO3固体加适量水溶解,先加稀盐酸再加BaCl2溶液,若有白色沉淀生成,则NaHSO3已变质;若无白色沉淀则未变质,故答案为:取少量NaHSO3固体加适量水溶解,先加稀盐酸再加BaCl2溶液,若有白色沉淀生成,则NaHSO3已变质;若无白色沉淀则未变质。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)T1℃时,在2L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为______(保留一位小数);在T1℃下反应2SO2(g)+O2(g) ![]() 2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
②下表为不同温度(T)下反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0的化学平衡常数(K):
2SO3(g) △H<0的化学平衡常数(K):
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,其他条件相同,在T1、T2、T3三种不同温度下,反应从开始至达到平衡时所需要的时间最长的是 _____________。(填“T1”、“T2”或“T3”)
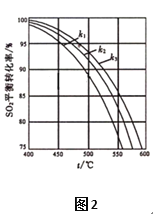
(2)在体系恒压的条件下进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
【题目】有X、Y、Z、W四种短周期主族元素,原子序数依次增大,元素性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
X | 原子核内没有中子 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 最内层电子数是最外层的2倍 |
W | 本周期元素中原子半径最小 |
请回答:
(1)写出元素Z在周期表中的位置______,画出元素W的原子结构示意图______。
(2)Y与W相比,气态氢化物稳定性较弱的是________(填化学式,下同),两元素最高价氧化物对应水化物酸性更强的是__________。
(3)X、Y、Z三种元素可以形成化合物ZYX2,可与化合物XW发生反应,生成两种盐,写出该反应的化学方程式________________。