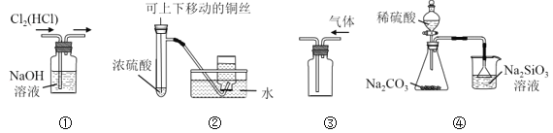
题目内容
【题目】三聚氰胺污染牛奶事件社会影响极坏。向牛奶和奶粉中添加三聚氰胺,主要是因为它能冒充蛋白质。已知三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126。为测定三聚氰胺的组成,用下列各仪器装置,在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2。回答下列问题:
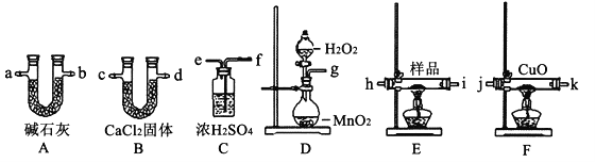
(1)产生的氧气按从左向右的流向,所选装置各导管的连接顺序是g接_______、____接___、____接j、k接___、____接___。
(2)装置F中CuO的作用是__________________________________________________。
(3)实验前后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺的分子式为_________________。
(4)按(1)的连接方法,此实验装置存在的缺点是______________________________。
【答案】 fehicda (或fehicdb或fehidca或fehidcb) 氧化没有燃烧完全的CO C3H6N6 空气中的水蒸气和CO2进入A装置,影响CO2的测定值。
【解析】(1)在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2,制取的氧气必须要用浓硫酸来干燥,所以开始连接顺序是f、e、h、i,一氧化碳含量测定用氧化铜,但是一氧化碳的检验必须在前,在测定一氧化碳的含量之前要用无水氯化钙对气体进行干燥,可以用A装置测定二氧化碳的量,并且放在最后来检测,所以连接顺序是:f、e、h、i、c、d、a,其中ABEF四个装置中气体可以从容易一端进或出,故答案为:f;e;h(或i);i(或h);c(或d);d(或c);a(或b);
(2)有机物燃烧产物含有一氧化碳,用氧化铜可以氧化没有燃烧完全的CO,故答案为:氧化没有燃烧完全的CO;
(3)三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,2.52g即0.02mol三聚氰胺样品氧化成CO2、H2O和N2,A、B两装置分别测定的是二氧化碳、水的质量,所以二氧化碳质量是2.64g,所以碳原子数目是3,即0.06mol,水的质量是1.08g,即0.06mol,所以氢原子个数是6,根据分子相对分子质量式126,所以氮原子数是3,即分子式为C3H6N6,故答案为:C3H6N6;
(4)为了保证测得二氧化碳中的碳元素全部来自有机物,所以要避开空气中二氧化碳的干扰,还缺少尾部缺少一个干燥装置,故答案为:尾部缺少一个干燥装置,空气中的水蒸气和CO2进入A装置,影响CO2测定值。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为 __________ g,假设广口瓶里生成一种正盐,其质量为 __________ g;
(2)生成的水中氢元素的质量为 __________ g;
(3)生成的二氧化碳中碳元素的质量为 __________ g;
(4)该燃料中碳元素与氢元素的物质的量之比为 __________ ;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为 __________ ,结构简式为 __________ .
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)T1℃时,在2L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为______(保留一位小数);在T1℃下反应2SO2(g)+O2(g) ![]() 2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
②下表为不同温度(T)下反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0的化学平衡常数(K):
2SO3(g) △H<0的化学平衡常数(K):
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,其他条件相同,在T1、T2、T3三种不同温度下,反应从开始至达到平衡时所需要的时间最长的是 _____________。(填“T1”、“T2”或“T3”)
(2)在体系恒压的条件下进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
【题目】三氯化氧磷(POCl3)可用作有机合成的氯化剂和催化剂,实验室制取POCl3并测定产品含量的实验过程如下:
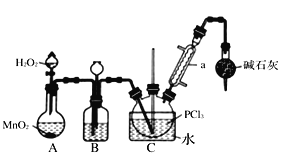
I.制备POCl3可用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略)及相关信息如下。
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其 他 |
PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)装MnO2的仪器名称是__________;干燥管的作用为_________________________。
(2)装置B中的液体药品是_____;装置B有三个作用,分别为______________________。
(3)三氯化氧磷还可由三氯化磷与水、氯气反应制备。此方法生产三氯化氧磷的化学方程式为____________________________________。
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待反应器中液体冷却到室温,准确称取一定质量的 POCl3产品(杂质不含氯元素),置于盛有100.00 mL蒸馏水的烧杯中摇动至完全水解,将水解液配成200.00 mL溶液
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 1.5 mol/L AgNO3标准溶液
③加入少量硝基苯,用力摇动,静置
④加入指示剂,用0.2 mol/L KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去15.00 mL KSCN溶液。
(4)选择的指示剂为___________。
(5)测得产品中n(POCl3)= ___________________________。(已知:磷酸银可溶于酸)
(6)已知Ksp(AgCl)> Ksp(AgSCN),步骤③的目的是________________________________。