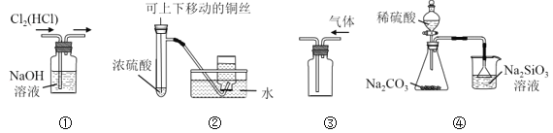
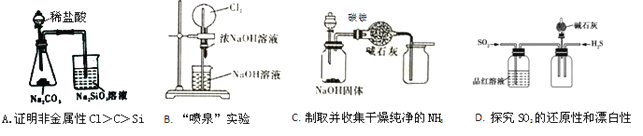
题目内容
【题目】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物),冬季空气污染严重也跟冬季燃煤密切相关。
SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)PM2.5是指大气中直径小于或等于2.5微米的可入肺的有害颗粒,下列有关说法中正确的是______(填字母)。
a.PM2.5在空气中一定能形成气溶胶
b.PM2.5比表面积大能吸附大量的有毒有害物质
c.PM2.5 主要来源于直接排放的工业污染物和汽车尾气等
d.酸雨、臭氧层破坏等环境问题与PM2.5无关
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-a kJmol-1
CH3OH(g)+H2O(g) △H=-a kJmol-1
2H2(g)+O2(g)=2H2O(g) △H=-b kJmol-1
H2O(g)-H2O(l) △H=-c kJmol-1
CH3OH(g)=CH3OH(l) △H=-d kJmol-1
则表示CH3OH(l)燃烧热的热化学方程式为________________________________。
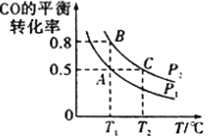
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
①下列说法不能判断该反应达到化学平衡状态的是______(填字母)。
a.H2的消耗速率是CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA_____ PB (填“>”、“<”或“=”)。
③若达到化学平衡状态A时。容器的体积为20L。如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=____________L。
(4)SO2在一定条件下可与氧气构成原电池。右图是利用该电池在铁表面镀铜的装置示意图:
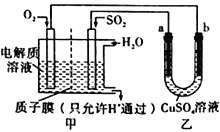
①该电池的负极反应:__________________________________;质于膜(只允许H通过)
②当甲中消耗2.24 LO2(标准状况)时,乙中__________(填“a”或“b”)增重_________g。
【答案】 bcd CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-(3/2b+2c-a-d)kJ·mol-1 ac < 4 SO2-2e-+2H2O=4H++SO42- a 12.8
【解析】试题分析:(1)PM2.5的直径大于100nm;PM2.5比表面积大,具有吸附性;工业污染物和汽车尾气等能形成PM2.5;SO2引起酸雨、氟氯烃引起臭氧层破坏;(2)CH3OH(l)燃烧热是1mol甲醇燃烧生成二氧化碳和液态水放出的能量;根据盖斯定律计算焓变;(3)①根据平衡标志分析;②增大压强,平衡正向移动,CO转化率增大;③A、B温度相同,平衡常数相同;(4)①负极是SO2失电子生成SO42-;②乙是在铁表面镀铜的装置,a与电源负极相连,a是阴极,a极反应式是![]() ;b是阳极,阴极反应式是
;b是阳极,阴极反应式是![]() ;
;
解析:(1)PM2.5的直径大于100nm,PM2.5在空气中不一定能形成气溶胶,故a错误;PM2.5比表面积大,具有吸附性,可以吸附有毒有害物质,故b正确;工业污染物和汽车尾气等能形成PM2.5,故c正确;SO2引起酸雨、氟氯烃引起臭氧层破坏,酸雨、臭氧层破坏等环境问题与PM2.5无关,故d正确;
(2)①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-a kJmol-1
CH3OH(g)+H2O(g) △H=-a kJmol-1
②2H2(g)+O2(g)=2H2O(g) △H=-b kJmol-1
③H2O(g)-H2O(l) △H=-c kJmol-1
④CH3OH(g)=CH3OH(l) △H=-d kJmol-1
CH3OH(l)燃烧热是1mol甲醇燃烧生成二氧化碳和液态水放出的能量;根据盖斯定律②![]() + ③
+ ③![]() -①-④得CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-(3/2b+2c-a-d)kJ·mol-1;(3)①a.H2的消耗速率是CH3OH的生成速率的2倍,都是正反应速率,故a错误; b.H2的体积分数不再改变,一定达到平衡状态,故b正确; c.设CO的变化量为xmol,则氢气的变化量为2xmol, H2的转化率是
-①-④得CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-(3/2b+2c-a-d)kJ·mol-1;(3)①a.H2的消耗速率是CH3OH的生成速率的2倍,都是正反应速率,故a错误; b.H2的体积分数不再改变,一定达到平衡状态,故b正确; c.设CO的变化量为xmol,则氢气的变化量为2xmol, H2的转化率是![]() 、CO的转化率是
、CO的转化率是![]() ,转化率始终相等,故c错误; d.根据
,转化率始终相等,故c错误; d.根据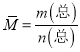 ,n是变量,所以平均摩尔质量是变量,体系中气体的平均摩尔质量不再改变,一定达到平衡状态,故d正确。选ac;②根据图示,温度相同,压强为
,n是变量,所以平均摩尔质量是变量,体系中气体的平均摩尔质量不再改变,一定达到平衡状态,故d正确。选ac;②根据图示,温度相同,压强为![]() 时CO的转化率大于
时CO的转化率大于![]() ,增大压强,平衡正向移动,CO转化率增大,所以PA< PB;
,增大压强,平衡正向移动,CO转化率增大,所以PA< PB;
③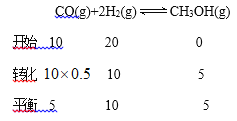
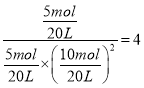 ,
,
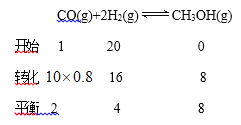
设平衡状态B时容器的体积V(B)=aL, 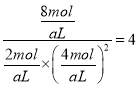 ,a=4L;(4)①负极是SO2失电子生成SO42-,负极电极反应式是SO2-2e-+2H2O=4H++SO42-;②乙是在铁表面镀铜的装置,a与电源负极相连,a是阴极,a极反应式是
,a=4L;(4)①负极是SO2失电子生成SO42-,负极电极反应式是SO2-2e-+2H2O=4H++SO42-;②乙是在铁表面镀铜的装置,a与电源负极相连,a是阴极,a极反应式是![]() ;b是阳极,阴极反应式是
;b是阳极,阴极反应式是![]() ;所以乙中a极增重,当甲中消耗2.24 LO2(标准状况)时,转移电子0.4mol,根据
;所以乙中a极增重,当甲中消耗2.24 LO2(标准状况)时,转移电子0.4mol,根据![]() ,a极生成铜0.2mol,质量是12.8g。
,a极生成铜0.2mol,质量是12.8g。

【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)T1℃时,在2L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为______(保留一位小数);在T1℃下反应2SO2(g)+O2(g) ![]() 2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
②下表为不同温度(T)下反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0的化学平衡常数(K):
2SO3(g) △H<0的化学平衡常数(K):
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,其他条件相同,在T1、T2、T3三种不同温度下,反应从开始至达到平衡时所需要的时间最长的是 _____________。(填“T1”、“T2”或“T3”)
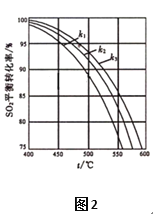
(2)在体系恒压的条件下进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
【题目】探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验:
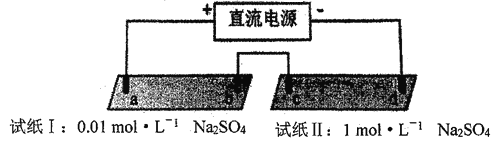
实验现象:
时间 | 试纸I | 试纸II |
lmin | a极附近试纸变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近…… |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
下列说法不正确的是
A. d极附近试纸变蓝
B. a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH-
C. 对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移
D. 试纸I的现象说明,此环境中H+的迁移速率比OH-快