题目内容
15.下列关于容量瓶及其使用方法的叙述,正确的是( )①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液
⑤可以用500mL容量瓶配制450mL溶液.
| A. | 除了③ | B. | ①②④ | C. | ③⑤ | D. | 除了⑤ |
分析 容量瓶用来配置一定物质的量浓度的溶液,使用前要先检查容量瓶是否漏液,不能用来加热,不能用容量瓶贮存配制好的溶液,容量瓶只有一个刻度.
解答 解:①容量瓶是配制一定物质的量浓度的溶液的专用仪器,故①正确;
②容量瓶使用前要先检查容量瓶是否漏液,故②正确;
③容量瓶不能用来加热,故③错误;
④容量瓶不能用容量瓶贮存配制好的溶液,故④正确;
⑤容量瓶只有一个刻度,无法配制450ml溶液,须采用稍大一点的500mL的容量瓶,配置同浓度的溶液500ml,再量取450ml即可,故⑤正确;
故选A.
点评 本题考查容量瓶的使用,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
相关题目
3.常温下,下列各组微粒在指定的溶液中一定大量存在都是( )
| A. | NaAlO2溶液中:Cl-、HCO3-、K+、Ba2+ | |
| B. | FeCl3溶液中:K+、NH4+、Br-、SCN- | |
| C. | $\frac{c{(H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| D. | KMnO4的溶液中:H+、SO42-、CH3CH2OH |
10.钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染.
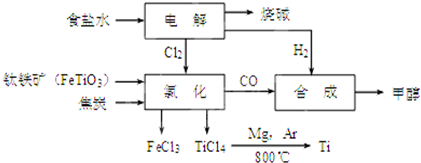
请回答下列问题:
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为$\frac{cVM}{10w}$%.(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.

请回答下列问题:
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.
20.向100ml碘化亚铁溶液中缓慢通入标况下4.48L氯气,完全反应后,溶液中有一半的Fe2+未被氧化,则原碘化亚铁溶液的物质的量浓度是( )
| A. | 1.2mol/L | B. | 1.5mol/L | C. | 1.6mol/L | D. | 2.0mol/L |
7.生活处处有化学.下列说法正确的是( )
| A. | 糖类化合物都具有相同的官能团 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的酯类 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
4.短周期元素A、M、X、Y、Z、E的原子序数依次增大,其元素特征信息如下表
(1)M与X形成的化合物X2M2中含有的化学键为离子键、共价键;X、Y的最高价氧化物对应的水化物之间发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.(用元素符号表示,下同)
(2)Y E3的水溶液显酸性,用离子方程式解释原因Al3++3H2O?Al(OH)3+3H+;Z的低价氧化物和E单质同时通入水中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(3)请用“>”、“=”或“<”对物质性质进行比较
(4)X、Y、Z、E四种元素简单离子的离子半径由小到大的顺序是r (Al3+)<r (Na+)<r (Cl-)<r (S2-).
(5)E的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
| 元素编号 | 元素特征信息 |
| A | 单质是密度最小的气体 |
| M | 其单质为生命活动不可缺少的气体 |
| X | 短周期中原子半径最大的元素 |
| Y | 地壳中含量最高的金属元素 |
| Z | 最外层电子数是最内层电子数的3倍 |
| E | 单质为黄绿色气体 |
(2)Y E3的水溶液显酸性,用离子方程式解释原因Al3++3H2O?Al(OH)3+3H+;Z的低价氧化物和E单质同时通入水中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(3)请用“>”、“=”或“<”对物质性质进行比较
| 沸点 | 气态氢化物稳定性 | 最高价氧化物 对应水化物的碱性 | 得电子能力 |
| A2M>A2Z | Z< E | X> Y | 16M= 18M |
(5)E的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
 生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.