题目内容
20.能正确表示下列反应的离子方程式的是( )①Ba(OH)2溶液与MgSO4溶液反应:Mg2++2OH-═Mg(OH)2↓
②铁跟稀盐酸反应:Fe+2H+═Fe2++H2↑
③铁跟硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu
④碳酸氢钠跟硫酸反应:2H++CO32-═CO2↑+H2O
⑤向Ba(OH)2溶液中加入NaHSO4至溶液呈中性:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓
| A. | ②③ | B. | ②③⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
分析 ①Ba(OH)2溶液与MgSO4溶液反应生成硫酸钡沉淀和氢氧化镁,漏掉了生成硫酸钡的反应;
②铁跟稀盐酸反应生成氯化亚铁和氢气;
③铁跟硫酸铜溶液反应生成硫酸亚铁和铜;
④碳酸氢钠跟硫酸反应生成硫酸钠、二氧化碳气体和水,碳酸氢根离子不能拆开;
⑤向Ba(OH)2溶液中加入NaHSO4至溶液呈中性,氢氧化钡与硫酸氢钠按照物质的量1:2反应.
解答 解:①Ba(OH)2溶液与MgSO4溶液反应生成硫酸钡沉淀和氢氧化镁沉淀,正确的离子方程式为:SO42-+Ba2++Mg2++2OH-=Mg(OH)2↓+BaSO4↓,故①错误;
②铁跟稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+═Fe2++H2↑,故②正确;
③铁跟硫酸铜溶液反应的离子方程式为:Fe+Cu2+═Fe2++Cu,故③正确;
④碳酸氢钠跟硫酸反应,碳酸氢根离子不能拆开,正确的离子方程式为:H++HCO3-═CO2↑+H2O,故④错误;
⑤向Ba(OH)2溶液中加入NaHSO4至溶液呈中性,反应的离子方程式为:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓,故⑤正确;
根据分析可知,正确的为②③⑤,
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
10.钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染.
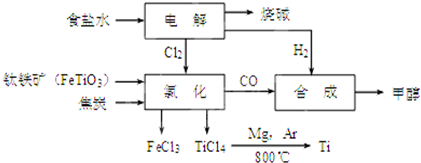
请回答下列问题:
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为$\frac{cVM}{10w}$%.(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.

请回答下列问题:
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.
11.能正确表示下列反应的离子方程式是( )
| A. | Cl2溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| B. | NaHCO3溶液中加入HCl:CO32-+2H+=CO2↑+H2O | |
| C. | 少量二氧化碳通入足量的NaOH溶液:CO2+OH-═HCO3- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
8.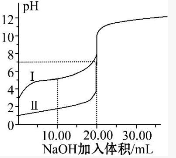 室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
 室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00 mL时,QUOTE>1 | |
| C. | 当V(NaOH)=20.00 mL时,两种酸溶液的pH均等于7 | |
| D. | V(NaOH)=20.00 mL时,c(Cl-)<c(CH3COO-) |
15.下列有关化学实验安全的叙述中正确的是( )
| A. | 点燃的酒精灯不小心打翻了,应立即用自来水灭火 | |
| B. | 皮肤沾上少量浓硫酸后,可先用大量水冲洗,再涂上稀碳酸氢钠溶液 | |
| C. | 在蒸馏实验中,加热一段时间后,忘了加入沸石,打开瓶塞立即加入沸石 | |
| D. | 冷凝管用作冷凝回流时,为防止有机物蒸汽逸出,可使用橡胶塞塞住顶端出口 |
9.经氯气消毒的自来水,用以配制以下溶液,不会使溶液变质的是( )
| A. | AgNO3溶液 | B. | FeCl2溶液 | C. | Na2CO3溶液 | D. | NaCl溶液 |
10.在下列操作中,所使用的仪器能够达到目的是( )
| A. | 用5mL量筒准确量取4.55mL水 | |
| B. | 用分析天平准确地称取6.82g食盐 | |
| C. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
 为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如图实验,请回答下列问题:
为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如图实验,请回答下列问题: