题目内容
下列物质的化学用语正确的是
①NH4H的电子式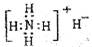
②硝基苯的结构简式: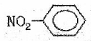
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型: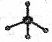
⑤Fe2+的离子结构: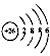
⑥原子核内有10个中子的氧原子: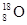
⑦sp2杂化轨道模型: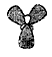
| A.②③⑤ | B.①③⑤⑥ | C.③⑥⑦ | D.②③⑥⑦ |
C
解析试题分析:①H-是阴离子,它的电子式也应该写出来。错误。②硝基苯中应该是N原子与苯环的碳原子相连。错误。③葡萄糖分子式C6H12O6;实验式是:CH2O。正确。④是球棍模型。错误。⑤Fe2+和外有三个电子层,个层上含有的电子数分别是2、8、14.错误。⑥原子核内有10个中子的氧原子: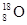 正确。⑦杂化轨道模型是sp2原子的。正确。故物质的化学用语正确的是③⑥⑦。选项为:C.
正确。⑦杂化轨道模型是sp2原子的。正确。故物质的化学用语正确的是③⑥⑦。选项为:C.
考点:考查物质的化学用语的知识。

练习册系列答案
相关题目
用 A表示阿伏加德罗常数的值。下列说法正确的是
A表示阿伏加德罗常数的值。下列说法正确的是
A.1 mol Cl-离子中含有的电子数为8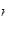 A A |
B.标准状况下,2.24 L H20中含有的分子数为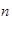 A A |
C.27g铝与足量的氧气反应,转移的电子数为3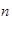 A A |
D.0.2 mo1·L-1 Ca(NO3)2溶液中含有的N03-离子数为0.4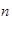 A A |
有Na2CO3、NaHCO3、CaO和NaOH组成的混合物28.2g,把它们溶于足量的水,充分反应后,溶液中Ca2+、CO32—、HCO3—均转化为沉淀,将容器中的水分蒸干,最后得到白色固体物质共30g。则下列有关叙述错误的是
| A.原混合物中含Na2CO3 0.1 mol |
| B.原混合物中n(Na2CO3)+n(NaHCO3)=n(CaO) |
| C.30g固体中一定存在n(CaCO3)<n(NaOH) |
| D.不能确定原混合物中NaOH的质量 |
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是( )
| A.ω=35a/(22.4Vρ) |
| B.c =a/(22.4V)mol/L |
| C.上述氨水中再加入等体积等浓度的稀盐酸后溶液恰好呈中性 |
| D.上述氨水中再加入V mL水后,所得溶液的质量分数小于0.5ω |
工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用相同条件下的NH3 3L恰好反应完全,则混合气中NO与NO2的体积分数比
| A.l:4 | B.1:3 | C.l:2 | D.l:l |
设NA为阿佛加德罗常数的值,下列叙述正确的是
| A.常温下 ,4gCH4含有NA 个C-H共价键 |
| B.1 mol Fe 与足量的稀HNO3反应,转移2 NA个电子 |
| C.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
下列化学用语的书写正确的是
| A.乙酸的分子式:C2H4O2 |
| B.乙醇的结构简式:C2H6O |
C.F原子结构示意图: |
D.四氯化碳的电子式: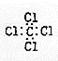 |
下列叙述正确的是
| A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| B.25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA |
| C.1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA |
| D.1.0L1.5mo1·L-1的NaAlO2水溶液中含有的氧原子数为3NA |
下列有关气体的叙述中,错误的是( )
| A.不同的气体,若体积不同,则它们所含的分子数肯定不同 |
| B.在标准状况下,气体的摩尔体积约为22.4 L·mol-1 |
| C.当分子数目相同时,气体体积的大小主要取决于气体分子之间的距离 |
| D.气态物质没有固定的形状,且容易被压缩 |