题目内容
相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )。
①它们所含的分子数目之比为1∶1
②它们所含的O原子数目之比为1∶2
③它们所含的原子总数目之比为2∶3
④它们所含的C原子数目之比为1∶1
⑤它们的质量之比为7∶11
| A.①④ | B.②③ | C.④⑤ | D.①②③④⑤ |
D
解析试题分析:题中CO和CO2的物质的量相同,所以含有的CO和CO2的分子数目也相同。则①的叙述是正确的。又因CO和CO2分子中的O原子数分别为1和2,则物质的量相同的CO和CO2,所含的O原子数目之比为1∶2。则②的叙述是正确的。对③来说,CO和CO2的分子中原子总数之比为2∶3,所以③的叙述也是对的。对④来说,物质的量相同的CO和CO2,C原子数目之比也是1∶1,则选项④也是对的。最后是⑤,CO的摩尔质量为28 g·mol-1,CO2的摩尔质量为44 g·mol-1,根据m=n×M,得出两者的质量之比为7∶11,则选项⑤也是正确的。所以,本题的正确答案应为D。
考点:本题考查了阿伏加德罗定律的运用。

练习册系列答案
相关题目
下列叙述正确的是
| A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| B.25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA |
| C.1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA |
| D.1.0L1.5mo1·L-1的NaAlO2水溶液中含有的氧原子数为3NA |
下列有关气体的叙述中,错误的是( )
| A.不同的气体,若体积不同,则它们所含的分子数肯定不同 |
| B.在标准状况下,气体的摩尔体积约为22.4 L·mol-1 |
| C.当分子数目相同时,气体体积的大小主要取决于气体分子之间的距离 |
| D.气态物质没有固定的形状,且容易被压缩 |
工业废气NO、NO2是造成大气污染的气体之一,工业上常用原理为NOx + NH3→N2 + H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是( )
| A.1:1 | B.1:3 | C.3:1 | D.2:1 |
设NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA |
| B.常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为1.5NA |
| C.常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |
| D.标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
下列有关化学用语的表示,正确的是
A.甲烷的电子式: |
B.CCl4分子的比例模型: |
| C.蔗糖与醋酸的最简式相同 |
D.2-甲基丁醇的结构简式: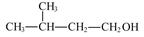 |
下列表达式错误的是
A.碳-12原子表示为 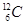 |
B.氮原子的L层电子的电子排布图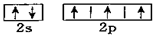 |
| C.硫离子的核外电子排布式1s22s22p63s23p6 |
D.NH4Cl的电子式为: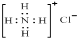 |
正确掌握化学用语和化学基本概念是学好化学的基础,下列有关表述中正确的一项是( )
| A.蔗糖与醋酸的最简式相同 |
| B.16O与18O互为同位素,H216O、D216O、H218O、D218O互为同素异形体 |
C.SiH4、CH4、 粒子的空间构型为正四面体型;CO2、C2H2均为直线型分子 粒子的空间构型为正四面体型;CO2、C2H2均为直线型分子 |
D.Ca2+的结构示意图为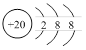 ;NH4Cl的电子式为 ;NH4Cl的电子式为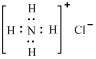 |