题目内容
【题目】向含Fe(NO3)3、Cu(NO3)2、HNO3的某种稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。下列说法错误的是( )
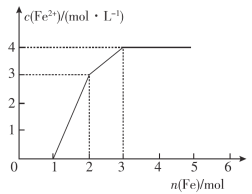
A.横轴0~1:Fe+NO![]() +4H+==Fe3++NO↑+2H2O
+4H+==Fe3++NO↑+2H2O
B.横轴1~2:Fe+2Fe3+=3Fe2+
C.横轴2~3:Fe+Cu2+=Fe2++Cu
D.原溶液中三种溶质浓度相等
【答案】D
【解析】
根据氧化性:HNO3>Fe3+>Cu2+,Fe先与氧化性强的物质反应,即Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,然后是:Fe+2Fe3+=3Fe2+,最后阶段Fe+Cu2+═Fe2++Cu,由图中起点、拐点、终点的位置来确定化学反应情况。
Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液氧化性为HNO3>Fe3+>Cu2+,金属铁先和氧化性强的离子反应;
A.开始阶段是金属铁和硝酸之间的反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,当加入金属铁1mol是,生成三价铁离子是1mol,所以亚铁离子的浓度不变,故A正确;
B.金属铁和硝酸反应结束后,生成1mol的三价铁离子,然后发生反应Fe+2Fe3+=3Fe2+,此时加入的1mol铁会和三价铁反应生成3mol亚铁离子,故B正确;
C.反应的最后阶段为:Fe+Cu2+=Fe2++Cu,所有的离子均被还原,故C正确;
D.根据以上分析,整个过程的反应为:4H++NO3-+3Fe+Fe3++Cu2+=4Fe2++Cu+NO↑+2H2O,则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为1:1:4,故D错误;
故答案为D。

练习册系列答案
相关题目